
 ;
;分析 (1)配合物中中心原子提供空轨道,配体提供孤电子对;配位键由提供孤电子对的原子指向提供空轨道的原子;
(2)根据价层电子对互斥理论确定VSEPR模型,去掉孤电子对后就是该微粒的立体构型;
(3)由第二周期元素为中心原子,通过SP3杂化形成中性分子,如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,如果是V型分子,则该分子中价层电子对个数是4且具有2个孤电子对.
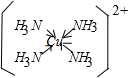
解答 解:(1)在配合物离子[Fe(SCN)]2+中,中心离子是Fe3+,提供提供空轨道接受孤对电子,配合物离子[Cu(NH3)4]2+中的配位键为 ;
;
故答案为:Fe3+;
(2)NH4+中氮原子杂化轨道数=4+$\frac{1}{2}$(5-1-3×1)=4+0=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化,分子形状为正四面体形;,BCl3分子中价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,且含有一个孤电子对,所以其立体结构为平面三角形(正三角形),
故答案为:正四面体;正三角形(平面三角形);
(3)由第二周期元素为中心原子,通过SP3杂化形成中性分子,
如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,该类型分子有:CH4或CF4,
如果是三角锥型分子,则该分子中价层电子对个数是4且含有一个孤电子对,该类型分子有NH3或NF3,
如果是V型分子,则该分子中价层电子对个数是4且具有2个孤电子对,该类型分子有H2O,
故答案为:CH4或CF4;NH3或NF3;H2O.
点评 本题考查了价层电子对互斥理论、配合物等知识点,根据价层电子对互斥理论确定分子构型、原子杂化方式结合配合物结构特点分析解答本题,注意孤电子对个数计算公式中各个字母的含义,题目难度中等.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
实验是化学研究的基础.下列关于各实验装置的叙述正确的是( )
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的PH大于1 | |
| B. | c(OH-)=c(H+)-C(CH3COO-) | |
| C. | 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性 | |
| D. | 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中,化学能全部转化为热能 | |
| B. | 已知C(s)+$\frac{1}{2}$O2(g)═CO(g),△H=-110.5kJ•mol-1,则碳的燃烧热为-110.5kJ•mol-1 | |
| C. | 测定中和热时,用铜制搅拌棒代替环形玻璃搅拌棒不影响测定结果 | |
| D. | 反应C(s)+CO2(g)═2CO(g)△H>0在较高温度下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 1 | C. | 0.5 | D. | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用浓硫酸的吸水性,干燥氢气 | |
| B. | 碳酸氢钠溶液呈碱性,可用于治疗胃酸过多 | |
| C. | 氯化铝是电解质,电解熔融的氯化铝制备金属铝 | |
| D. | 镁在空气中燃烧时发出耀眼的白光,可用于制造信号弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、Cu2+、Fe3+、Ca2+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
| A. | 溶液中一定含有的离子是K+、Cl-、CO32-、NO3-、SO42- | |
| B. | Ⅰ中加入盐酸生成无色气体的离子方程式是CO32-+2H+═CO2↑+H2O | |
| C. | 原溶液中的K+、Cl-、NO3-存在与否无法确定 | |
| D. | Ⅱ中产生白色沉淀的离子方程式是Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com