
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
 (2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。

①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为
0.25 mol/L)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,在一定条件下,用CH4还原NOX可以消除氮氧化物的污染。
 例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
写出CH4还原N2O4(g)生成N2和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放目的。通过人工光合作用,以CO2和H2O为原
料可以制备HCOOH和O2,计算标况下每回收1.0m3 CO2转移的电子数为 个。
③常温下,0.1mol/L的HCOONa溶液的pH为10,则HCOOH的电离常数Ka = 。
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式,不正确的是
A.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+===I2+O2↑+2H2O
B.自然 界中正常的雨水呈酸性:
界中正常的雨水呈酸性:
H2O+CO2H2CO3H++HCO
C.将1 mol·L-1NaAlO2溶液和1 mol·L-1的H2SO4溶液等体积均匀混合:
3AlO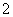 +6H+===2Al(OH)3↓+Al3+
+6H+===2Al(OH)3↓+Al3+
D.向明矾溶液中滴加氢氧化钡溶液至SO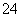 完全沉淀:Al3++2SO
完全沉淀:Al3++2SO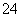 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO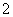 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知涤纶树脂的结构简式为:

(1)写出合成涤纶树脂所需要单体的结构简式:________和________。
(2)写出以对二甲苯、乙烯、食盐、氧化剂和水为原料,合成涤纶树脂的化学方程式。
__________________________________________________
__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
ΔH=-196.6 kJ/mol
2NO(g)+O 2(g)
2(g)  2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=________ kJ/mol。
SO3(g)+NO(g)的ΔH=________ kJ/mol。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
 (2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_____________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是: ( )
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是 ( )
A.SO2、SiO2、CO、Mn2O7均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液、淀粉溶液均为胶体
C.烧碱、冰醋酸、四氯化碳、氨气均为电解质
D.福尔马林、水玻璃、氨水、双氧水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明的混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色。下列对于原混合气体成分的判断中正确的是 ( )
A.肯定有SO2、O2和NO
B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2
D.肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘。反应分两步进行:IO3-+3HSO3-=I-+3SO42-+3H+;IO3-+5I-+6H+=3I2+3H2O。下列说法错误的是( )
A、NaIO3是氧化剂, HSO3-是还原剂
B、生产中可得到副产物H2SO4和Na2SO4
C、I2既是氧化产物又是还原产物
D、HSO3-的还原性比I-弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com