
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 A.60
mL B.45 mL C.30 mL D.50 mL
科目:高中化学 来源: 题型:
乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式: 。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3 mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A. NO2通入FeSO4溶液中 B. CO2通入CaCl2溶液中
C. NH3通入AlCl3溶液中 D. SO2通入已酸化的Ba( NO3 )2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
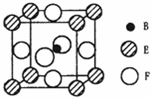 (5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有3份等质量的小苏打,第1份直接与过量盐酸反应;第2份先加热,使其部分分解后,再与过量盐酸反应;第3份先加热,使其完全分解后,再与过量盐酸反应。假若盐酸的物质的量浓度相同,实际消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A.V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V1=V2=V3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子能在溶液中大量共存,向溶液中加入NaOH溶液时产生沉淀,且加入盐酸时放出气体的离子组是
A.OH-、Ba2+、NO3-、K+ B.Fe2+、Ca2+、Br-、NO3-
C.Na+、SO42-、Cu2+、Cl- D.CO32-、Cl-、Na+、Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是:
A.5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
B.14g乙烯、丙烯的混合气体含有C-H数为2NA
C.标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)某溶液中只含有K+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,回答下列问题:
①该反应中的氧化剂是_______________。
②用单线桥表示此反应转移的电子数目及方向。
___________________________________________________________________________
③若氧化产物比还原产物多1.75 mol,上述反应转移的电子数目为 。
(3)镁、铝合金3 g与100 mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4 g,则原硫酸溶液的物质的量浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com