
下列说法正确的是( )
A. 阴、阳离子间通过静电引力所形成的化学键是离子键
B. 含有共价键的化合物必是共价化合物
C. 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D. 液态氯化氢中存在H+和Cl﹣,所以能导电
考点: 离子化合物的结构特征与性质;共价键的形成及共价键的主要类型.
专题: 化学键与晶体结构.
分析: A.阴、阳离子间通过静电作用所形成的化学键是离子键;
B.含有共价键的化合物可能是离子化合物;
C.化学变化的实质是有旧化学键的断裂和新化学键的形成;
D.液态氯化氢是由氯化氢分子构成的,不存在阴阳离子.
解答: 解:A.阴、阳离子间通过静电作用所形成的化学键是离子键,静电作用包含吸引力和排斥力,故A错误;
B.含有共价键的化合物可能是离子化合物,如KOH,故B错误;
C.化学变化的实质是有旧化学键的断裂和新化学键的形成,所以化学变化过程,一定会破坏旧的化学键,同时形成新的化学键,故C正确;
D.液态氯化氢是由氯化氢分子构成的,不存在阴阳离子,所以液态氯化氢不导电,故D错误;
故选C.
点评: 本题考查了离子键的概念、化学键与化合物的关系、化学变化的实质、物质的导电性等知识点,注意A中“静电作用”的含义、D中电解质与导电性的关系,这些都是易错点.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:
(1)反应中生成的H2在标准状况下的体积.
(2)所用盐酸中HCl中的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物的结构片段如下:
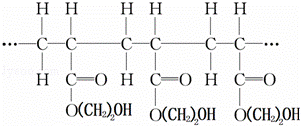
下列分析正确的是( )
|
| A. | 它是缩聚反应的产物 |
|
| B. | 其单体是CH2=CH2COOH和HOCH2CH2OH |
|
| C. | 其链节是CH3CH2COO(CH2)2OH |
|
| D. | 其单体是CH2=CHCOO(CH2)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则图中右侧Y形管中放置的药品组合不符合要求的是(必要是可以加热)( )
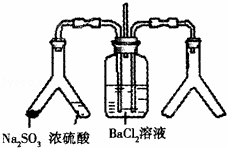
A. Cu和浓硝酸 B. CaO和浓氨水
C. 大理石和稀盐酸 D. 高锰酸钾溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是( )
A. C+HNO3 B. SO2+HNO3 C. Fe(OH)3+HNO3 D. FeO+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,发生下列几种反应①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O ②Cl2+2NaBr=2NaCl+Br2 ③Br2+2FeBr2=2FeBr3根据上述反应,下列结论正确的是( )
A. 还原性强弱顺序为:Br﹣>Fe2+>Cl﹣
B. 氧化性强弱顺序为:MnO4﹣>Cl2>Br2>Fe3+
C. 反应①中,当生成1mol Cl2时,被氧化的HCl为3.2mol
D. 溶液中可发生反应:2Fe3++2Cl﹣=2Fe2++Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
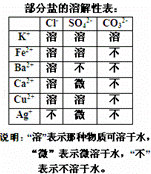
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl﹣、CO32﹣、SO42﹣,现每次取该溶液100.00mL溶液进行以下实验:
①第一份加入AgNO3溶液发现有沉淀生成;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g.
请回答下列问题:
(1)根据以上实验判断,原溶液中可能存在的离子是 .
(2)原溶液中一定存在的阳离子是 ,其物质的量浓度至少为 mol/l.
(3)原溶液中一定存在的阴离子是﹣ ,其物质的量浓度分别为 mol/L、 mol/l.
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的溶液中可以大量共存的离子组是( )
|
| A. | Ba2+、K+、NO3﹣、SO42﹣ | B. | OH﹣、Cl﹣、Na+、NH4+ |
|
| C. | Mg2+、K+、Cl﹣、NO3﹣ | D. | Cu2+、NO3﹣、OH﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
8.34g FeSO4•7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( )
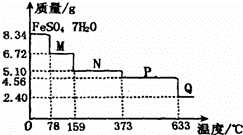
A. 温度为78℃时固体物质M的化学式为FeSO4•5H2O
B. 温度为l59℃时固体物质N的化学式为FeSO4•3H2O
C. 在隔绝空气条件下由N得到P的化学方程式为FeSO4 FeO+SO3↑
FeO+SO3↑
D. 取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com