
按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
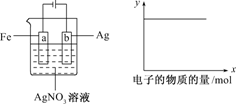
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④
C.①②④ D.①②⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)= CO(g)+H2(g) △H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池在放电时,电池总反应方程式可表示为:Zn+2MnO2+2NH4+=Zn 2++ Mn2O3+2NH3+H2O
在电池放电时,正极(碳棒)上发生反应的物质是
A. Zn B. 碳棒 C. MnO2和NH4+ D. Zn 2+和NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
全球气候变暖已经成为全世界人类面临的重大问题。
(1)地球上的能主要于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ:H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ/mol
Ⅱ:CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ/mol
Ⅲ:12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
(2)工业上有一种方法有效地开发利用CO2,是用CO2生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)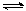 CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min);
②氢气的转化率= ;
③求此温度下该反应的平衡常数K= ;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1 c2的关系(填>、<、=)。
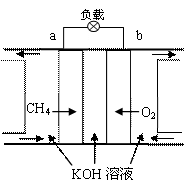
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如上图右所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液,从而达到吸收CO2的目的。
① 通入氧气一极的电极反应式为 ;
② 随着电池不断放电,电解质溶液的pH
(填“增大”、“减小”或“不变”)。
③通常情况下,甲烷燃料电池的能量利用率
(填大于、小于或等于)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质发生化学反应时,下列量值在反应前后肯定不发生变化的是 ( )
①电子总数; ②原子总数; ③分子总数; ④物质的种类;
⑤物质的总质量;⑥物质所具有的总能量。
A.①②⑤ B.②⑤⑥ C.①②③⑤ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
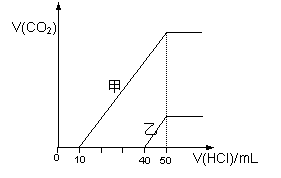
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
A.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况)
B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子
方程式为: OH-+H+→H2O
C.乙溶液中含有的溶质是NaOH、NaHCO3
D. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)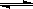 NaNO3(s)+ClNO(g) K1 Q > 0(I)
NaNO3(s)+ClNO(g) K1 Q > 0(I)
2NO(g)+Cl2(g)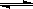 2ClNO(g) K2 Q > 0 (II)
2ClNO(g) K2 Q > 0 (II)
28.由(I)(II)得到:4NO2(g)+2NaCl(s)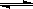 2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K= 。
2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K= 。
29.(2)为研究不同条件对反应(II)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内V(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。30.其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。31.若要使K2减小,可采用的措施是 。
32.实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ki=7.1×10-4mol?L?1,CH3COOH的电离常数K i=1.7×10-5mol?L?1)。
33.可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产、生活中有着广泛的应用.下列说法中不正确的是( )
A. 用植物秸秆、动物粪便等生产的沼气是一种清洁的能源
B. 手机上用的锂离子电池属于二次电池
C. 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
D. 研制开发燃料电池汽车,可有效降低机动车尾气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
将28 g铁粉放入100 mL 0.1 mol/L的CuSO4溶液中,充分反应后析出的铜的质量为( )
A.32 g B.6.4 g
C.0.64 g D.3.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com