
【题目】在下列能源中,属于二次能源的是
A. 风力 B. 原煤 C. 石油 D. 电力
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)![]() 2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
A | B | C | 0.75Q | |
① | 2 | 1 | 0 | |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是( )
A. 容器①中反应的平衡常数为18
B. 容器②中达到平衡时放出的热量为0.05QkJ
C. 向容器①中通入氦气,平衡时A的转化率增大
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-565.2 kJ·mol-1,下列说法不正确的是( )
A. CO(g)+![]() O2(g)===CO2(g) ΔH=-282.6 kJ·mol-1
O2(g)===CO2(g) ΔH=-282.6 kJ·mol-1
B. 2 mol CO(g)与1 mol O2(g)反应生成2 mol CO2(s)放出热量小于565.2 kJ
C. 相同条件下,2 mol CO(g)和1 mol O2(g)的总能量大于2 mol CO2(g)的总能量
D. 拆开2 mol CO(g)和1 mol O2(g)化学键所需的总能量低于形成2 mol CO2(g)化学键所放出的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物I为重要的化工原料,其合成路线如下:
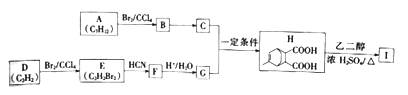
已知:①![]()
②![]()
(1)A的名称为______________,H的分子式为________________。
(2)B→C的反应条件为____________,E—F的反应类型为__________________。
(3)E的顺式结构式为_____________________。
(4)C+G→H的化学方程式为________________________。
(5)依据H→I的反应原理,写出HOOC![]() COOH与乙二醇合成有机高分子的的化学
COOH与乙二醇合成有机高分子的的化学
方程式________________________。
(6)B经过完全水解后得到M,则符合下列条件的M的同分异构体有______种(不考虑立体异构)
①能发生银镜反应 ②能与NaOH溶液发生反应
其中核磁共振氢谱有4组蜂且峰面枳比为9:2:2:1的结构简式为___________________。
(7)参照上述合成路线,写出由1,3-丁二烯和乙炔为起始原料合成![]() 的流程图(无机试剂任选)______________________。
的流程图(无机试剂任选)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用足量的MnO2和含有4 mol溶质的浓盐酸充分反应制氯气,下列说法正确的是( )
A. 该实验中共消耗1 mol MnO2,生成1 mol氯气
B. 为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C. 在该反应中MnO2作氧化剂,浓盐酸作还原剂
D. 氯气可以用向上排空气法或排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
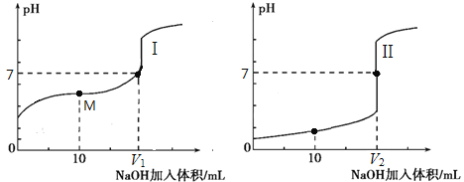
滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
写出步骤2中溶液变红色的离子方程式 。
步骤3中现象a是 。
用化学平衡原理解释步骤4的实验现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含 Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为( )
①加入足量氯水 ②加入足量I2水 ③加入少量KSCN溶液.
A.①③B.③②C.③①D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙氨酸(C3H7NO2)分子为手性分子,它存在手性异构体,如下图所示:

下列关于丙氨酸的两种手性异构体(Ⅰ和Ⅱ)的说法正确的是( )
A. Ⅰ和Ⅱ分子中均存在2个手性碳原子
B. Ⅰ和Ⅱ呈镜面对称,具有不同的分子极性
C. Ⅰ和Ⅱ分子都是极性分子,只含有极性键,不含非极性键
D. Ⅰ和Ⅱ的化学键相同,但分子的性质不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com