
| n |
| 3 |
| [NH3]2 |
| [N2]?[H2]3 |
| 1.22 |
| 1.23×0.4 |
| 1 |
| 4 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯与Br2发生加成反应生成CH3CHBr2 |
| B、酸性高锰酸钾溶液可确定苯和乙醇的混合液中混有乙醇 |
| C、葡萄糖、油脂、蛋白质都是可水解的高分子化合物 |
| D、乙烯和苯都是平面结构,因为二者分子中都含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | ||
B、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| C、浓度均为0.1mol?L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | ||
| D、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液中滴入盐酸 |
| B、水中加入钠 |
| C、氨水中加入少量NH4Cl 固体 |
| D、醋酸溶液微热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
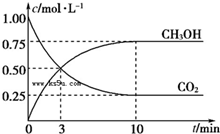 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A、欲增大平衡状态时c(CH3OH)/c(CO2)的比值,可采用升高温度的方法 |
| B、3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同 |
| C、欲提高H2的平衡转化率只能减小反应容器的体积 |
| D、从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
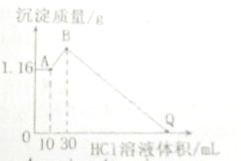 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浑浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示.请回答
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浑浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示.请回答查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com