
德国和美国科学家首次研制出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由多个正五边形构成的(如图所示)。请回答:
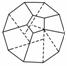
(1)C20分子中共有________个正五边形,共有 条棱边。C20晶体属于________(填晶体类型)。
(2)固体C60与C20相比较,熔点较高的应为________,理由是_________________。
科目:高中化学 来源: 题型:
金属晶体的形成是因为晶体中存在( )
A.金属阴离子间的相互作用
B.金属原子间的相互作用
C.金属阳离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是( )
A.C3N4是分子晶体
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过分子间作用力结合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.含有非极性共价键的化合物分子一定是非极性分子
B.原子晶体中只存在非极性共价键
C.冰主要是水分子通过氢键作用而形成的分子晶体
D.若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型的叙述,不正确的是( )
A.PCl3分子中P采用sp3杂化
B.PCl3分子中P—Cl键属于极性共价键
C.PCl3分子中三个共价键键能、键角均相等
D.PCl3是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.P4和CO2分子中都只含有共价键
B.CCl4和NH3分子的空间结构都是正四面体形
C.BF3分子中各原子均达到8e-稳定结构
D.甲烷的结构式为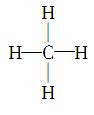 ,它是对称的平面形分子
,它是对称的平面形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.C2H6O和C4H10都有两种同分异构体
B.在一定条件下,乙烯能与H2发生加成反应,苯不能与H2发生加成反应
C.乙酸乙酯、乙酸均能与NaOH反应,二者分子中官能团相同
D.淀粉和蛋白质均可水解生成葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com