
����˵����ȷ����
A�������ۼ���FeCl3��CuCl2�����Һ�У���ַ�Ӧ��ʣ��Ĺ����б�����
B������FeCl3��Һ��20��ʱ�����ػ�ɫ��100����ֺ��ɫ,������ƽ���ƶ�ԭ��������
C����c��H+��/c��OH����= l012 ��Һ�� N a+��I����NO3����SO42�����ܴ�������
D����ԭ���װ���У����ӴӸ����������ص�����������������Һ�����Żص�����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йػ�ѧ�����ʹ����ȷ����
A��NH4Cl�ĵ���ʽ�� B��S2-�Ľṹʾ��ͼ��
C��CO2�Ľṹʽ��O=C=O D��������Ϊ37����ԭ��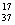 Cl
Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±�Ϊ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء�
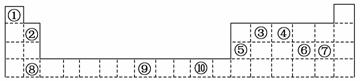
��ش��������⣺
��1�������� ����Ԫ�أ��ڸ�Ԫ���γɵĶ������ӵ���Һ�еμӰ�ˮ��������д���˹��������з�Ӧ�����ӷ���ʽ�� ��������
��2��д��Ԫ�آ�Ļ�̬ԭ�ӵ���Χ�����Ų�ʽ��������������������������������
��3��д�����ͬ���壬�䵥���������뵼���Ԫ�ط��� ��
��4���±��г��ˢ١���Ԫ���γɵĻ�ѧ���ļ��ܣ�
| ��ѧ�� | �١��� | �١��� | �ܡ��� | ��=�� | �ܡԢ� |
| ����/kJ��mol−1 | 436.0 | 390.8 | 193 | 418 | 946 |
��д���١��������ʷ�����Ӧ���Ȼ�ѧ����ʽ�� ��
�������VSEPRģ���� ���ռ乹��Ϊ ������Ϊ
��5���� ���� ��Ԫ�ص�����������Ӧˮ�����������ǿ�Ļ�ѧʽ�ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1993��8�£�����ԭ����ίԱ��ȷ���ҹ����������ڲⶨ�������ԭ��������121.760��Ϊ�����ԭ����������֪��������������Ȼͬλ�أ���121.760�ǣ� ��
A����Ԫ�ص�������12Cԭ������1��12�ı�ֵ
B��һ����ԭ�ӵ�������12Cԭ������1��12�ı�ֵ
C�������������Ȼͬλ�ص����ԭ��������������ռһ���ٷֱȼ������ƽ��ֵ
D�������������Ȼͬλ������������Щͬλ����ռ��һ���ٷֱȼ������ƽ��ֵ��֪
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ�Ѿ�������������ĸ������棬����˵������ȷ����
A������ּ���������Ҫ�ǵ绯ѧ��ʴ����
B�������еĻ������ڼ��Ի���������ɫ���ʿ����մ�ۼ�������Ѿ�
C������������Ӧ���ڵ��ӹ�ҵ��һ�������л��߷��ӻ�����
D. �ൺ���������������ݻ�ѧ��������ת��ԭ�������Զ��������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ظ�����ǹ�ҵ������ʵ���ҵ���Ҫ����������ҵ�ϳ��ø�������Ҫ�ɷ�ΪFeO��Cr2O3������ΪSiO2��Al2O3��Ϊԭ��������ʵ����ģ�ҵ���ø�������K2Cr2O7����Ҫ��������ͼ���漰����Ҫ��Ӧ��: 6FeO��Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
��1�����ǰ������������Ŀ���� ��
��2������۵���pH����˵õ��������� ��
��3���������У��ữʱ��CrO42-ת��ΪCr2O72-��д��ƽ��ת�������ӷ���ʽ ��
��4���ü�Ҫ������˵�������ݼ���KC1��ԭ��
��5��Ŀǰ��������Cr2O72-��ˮ������������巨���÷������ˮ�м���FeSO4 ��7H2O��Cr2O72-��ԭ��Cr3+������pH��Fe��Crת�����൱��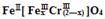 ����������,�������ֱ�ʾԪ�ؼ�̬���ij���������1mol Cr2O72-�������a mol FeSO4 ? 7H2O�����н�����ȷ����_______��
����������,�������ֱ�ʾԪ�ؼ�̬���ij���������1mol Cr2O72-�������a mol FeSO4 ? 7H2O�����н�����ȷ����_______��
A��x =0.5 ,a =8 B��x =0.5 ,a = 10 C��x = 1.5 ,a =8 D��x = 1.5 ,a = 10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ͬ����X��Y��Z����Ԫ�ص�����������Ӧˮ����������ǿ������˳��ΪHXO4>H2YO4>H3ZO4���������ж�����ȷ����
A�����ʵ�������X��Y��Z��˳����ǿ
B�������ӵĻ�ԭ��X��Y��Z��˳�����
C����̬�⻯����ȶ���X��Y��Z��˳����ǿ
D��Ԫ�طǽ�����X��Y��Z��˳�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��1.01��105 Pa��298 K�����£�2 mol������ȫȼ������ˮ�����ų�484 kJ�������������Ȼ�ѧ����ʽ��ȷ���� (����)
A��2H2(g)��O2(g)===2H2O(l) ��H����484 kJ/mol
B��H2(g)��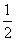 O2(g)===H2O(g) ��H����242 kJ/mol
O2(g)===H2O(g) ��H����242 kJ/mol
C��H2(g)��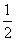 O2(g)===H2O(g) ��H��+242 kJ/mol
O2(g)===H2O(g) ��H��+242 kJ/mol
D��2H2(g)��O2(g)===2H2O(g) ��H��+484 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��aAn+��bB2-�������ӵĺ�����Ӳ�ṹ��ͬ����a����ֵΪ( )
A.b+n+2 B.b+n-2 C.b-n-2 D.b-n+2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com