
已知33As、35Br位于同一周期。下列关系正确的是 ( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
科目:高中化学 来源: 题型:
在实验室鉴定氯酸钾晶体和1氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3
溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水,过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤是____________(填序号)。
(2)鉴定1氯丙烷中氯元素的操作步骤是____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.元素周期表中元素排序的依据是原子的核电荷数
B.元素周期表有16个纵行,也就是16个族
C.原子的最外层电子数相同的元素,一定属于同一族
D.电子层数相同的粒子,其对应元素一定属于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,
Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,能层数等于主族序数,W单
质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A. Z与Y形成的化合物可作为耐高温材料
B.WY2能与碱反应,但不能与任何酸反应
C.原子半径按X、Y、Z、R、W的顺序依次增大
D.熔沸点:X2R>X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子
最外层电子数之和为22。下列说法正确的是
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物 质WY2、
质WY2、 W3X4、WZ4均有熔点高、硬度大的特性
W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、R的原子序数依次增大,X单质在暗处与H2剧烈化合并发生爆炸,Y位于第IA族,Z所处的周期序数与族序数相等,W元素最高正价与最 低负价之和为0,R与X同族,则
低负价之和为0,R与X同族,则
A.原子半径:Z>Y>X
B.X与R的核电荷数相差18
C.气态氢化物稳定性:W>R
D.Y与Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
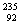 U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。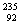 U的浓缩一直为国际社会关注。下列有关
U的浓缩一直为国际社会关注。下列有关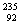 U说法正确的是( )
U说法正确的是( )
A.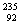 U原子核中含有92个中子 B.
U原子核中含有92个中子 B.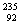 U原子核外有143个电子
U原子核外有143个电子
C.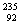 U与
U与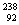 U互为同位素 D.
U互为同位素 D.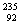 U与
U与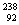 U互为同素异形体
U互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1) (2012·海南,9D)原子核内有18个中子的氯原子: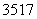 Cl ( )
Cl ( )
(2) (2008·广东理基,25A) Na2O2中氧元素的化合价为-2 ( )
Na2O2中氧元素的化合价为-2 ( )
(3) (2009·广东理基,19D)高氯酸(HClO4)中氯元素的化合价为+7 ( )
(4) (2010·课标全国卷,7D)Cl-的结构示意图为 ( )
( )
(5) (2012·天津理综,3C)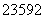 U和
U和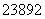 U是中子数不同质子数相同的同种核素 ( )
U是中子数不同质子数相同的同种核素 ( )
(6) (2009·山东理综,10B)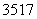 Cl、
Cl、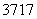 Cl为不同的核素,有不同的化学性质 ( )
Cl为不同的核素,有不同的化学性质 ( )
(7) (2010·山东理综,9B)16O与18O核外电子排布方式不同 ( )
(8) (2010·山东理综,9C)通过化学变化可以实现16O与18O间的相互转化 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
化学理论在元素单质及其化合物反应中应用广泛。
(1)在一定条件下,可逆反应mA nB+pC ⊿H,达到平衡状态。
nB+pC ⊿H,达到平衡状态。
①若A、B、C都是气体,增大压强,平衡向逆反应方向移动,则m (填“大于”、“小于”或“等于”)n+p。
②其他条件不变,加热后A的质量增加,则反应⊿H________0(填“大于”、“小于”或“等于”)。
 (3)一定温度下,发生反应:FeO(s)+CO(g)
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH。已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g) ΔH。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
请回答下列问题:
①该反应的ΔH___ 0(填“>”、“<”或“=”)。
②T℃时,将FeO(s)和CO(g)各3.0 mol加入10 L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2) =0.15mol·L-1,则温度T (填“高于”、“低于”、“等于”)1000, 若此时保持其它条件不变再充入2.0 mol CO(g),再达平衡时测得CO转化率为W2,则W1 (填“>”、“<”或“=”)W2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com