
| 探究内容 | 实验方案 | 实验现象 |
| 探究 Fe 2+ 具有还原性 | ||
| 探究 Fe 2+ 具有氧化性 |
| 实验方案 | 实验现象 |
| 在FeCl2溶液中加入适量氯水,再加入少量的KSCN溶液 | 加入适量氯水,溶液由浅绿色变为棕黄色,再加入少量的KSCN溶液,溶液变成血红色 |
| 在FeCl2溶液中加入锌片 | 溶液由浅绿色变为无色,锌片表面有黑色物质产生 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、两种气体A与B的相对分子质量之比为m:n |
| B、同质量气体A与B的分子数之比为m:n |
| C、同温同压下,A、B两气体的密度之比为n:m |
| D、相同状况下,同体积A、B两气体的质量之比为m:n |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
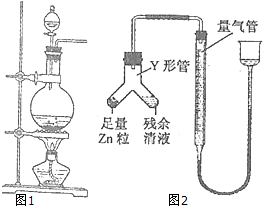 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 预期的转化 | 选择的试剂 | 实验现象 | 结论(用化学方程式表示) |
| ① | S→SO2 | 硫磺、 氧气 | -- | |
| ② | SO2→S | 二氧化硫、 硫化氢 | --- | SO2+2H2S═3S↓+2H2O |
| ③ | SO2→H2SO4 | 二氧化硫、 氯水 | 氯水退色 | |
| ④ | H2SO4→SO2 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- |
| B、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O |
| C、AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
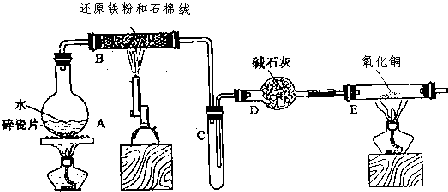
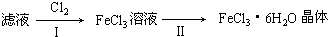
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com