
利用实验仪器(规格和数量不限),能完成相应实验的一项是
选项 | 实验仪器(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、酒精灯 | CuSO4溶液的浓缩结晶 |
B | 蒸馏烧瓶、冷凝管、酒精灯 | 由工业酒精制无水酒精 |
C | 天平、玻璃棒、胶头滴管、容量瓶 | 配制NaCl0.5 mol.L-1的溶液100 mL |
D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4,除去NaBr溶液中少量NaI |
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号)。其原因是 。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
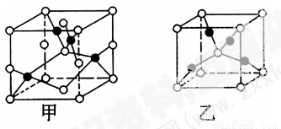
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
在温度不变的条件下,在恒容的容器中进行下列反应: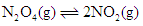 。若
。若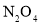 的浓度由
的浓度由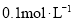 降到
降到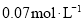 需要15s,那么
需要15s,那么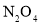 的浓度由
的浓度由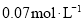 降到
降到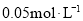 所需的反应时间( )
所需的反应时间( )
A.等于5s B.等于10s C.大于10s D.小于10s
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
| 2 |
|
| 2 | 3 | 4 |
|
| 6 |
|
|
| 6 | 7 |
11 |
|
|
| 11 |
| 11 | 12 | 13 |
| 14 |
| |||
19 |
|
|
| 19 |
|
| 24 |
| 31 | 32 |
|
A、 B、 C、 D、
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:填空题
(14分)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
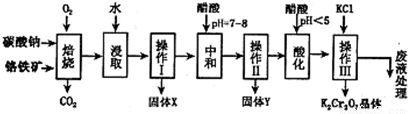
已知:①4FeO?Cr2O3+8Na2CO3+7O2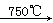 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3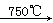 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 ______________ (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是 _______________________ 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是_____________________________。
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量 ____ (填写试剂)、溶解、过滤、再 (填写试剂)、……灼烧、冷却、称量,得干燥固体m g。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素,XW2分子与Y3?为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和。根据以上信息回答下列问题:
(1)X、Y、Z的电负性由大到小的顺序为 。
(2)XW2的电子式为 ,Y3?的分子构型为 型。
(3)Q的价电子排布式为 。
(4)下列关于WZ2结构的说法正确的是
A.WZ2为直线型非极性分子 B.WZ2为直线型极性分子
C.WZ2中W为sp3杂化 D.WZ2中W为sp2杂化
(5)α-QW的晶胞是立方体,用X射线粉末法测得该晶体晶胞边长a=520.0pm,26℃测得该晶体的密度为4.1g/cm3,请列式计算一个晶胞中含有的Q、W离子数。
(6)α-QW晶胞的一个侧面的投影图如右图所示,与Q离子距离最近且距离相等的W离子构成的几何图形是 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
常温下,关于1L pH=3的H2SO4溶液说法正确的是
A.与等体积pH=11氨水混合后所得溶液pH小于7
B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7
C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3
D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
向一定量的Fe、Fe0、Fe304的混合物中加人100mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,生成224 mL(标准状况)气体,向溶液中滴加KSCN溶液无红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为
A.2.8 g B.5.6 g C.11.2 g D.无法计算
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省益阳市高三下学期模拟考试理综化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列叙述中不正确的是
A.户外钢架桥生锈主要是电化学腐蚀所致
B.导电塑料是应用于电子工业的一种新型有机高分子材料
C.CO2、NO2或SO2都会导致酸雨的形成
D.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com