
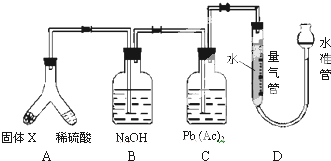
| A、固体X中一定有的物质是FeS、Fe 和S |
| B、B装置中的溶质一定是Na2S |
| C、C装置的作用是检验H2S是否完全被吸收 |
| D、X中其中一种物质的质量为V/400g |
| V×10-3L |
| 22.4L/mol |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.540 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.6720 | 1.344 | 2.688 |
| 硫的质量/g | 0.8000 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、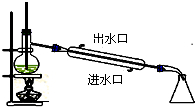 石油蒸馏 |
B、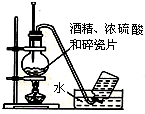 实验室用乙醇制取乙烯 |
C、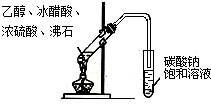 实验室制取乙酸乙酯 |
D、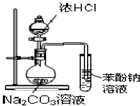 证明酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉溶液(葡萄糖):渗析 |
| B、乙醇(乙酸):加KOH溶液,分液 |
| C、甲醇溶液(甲酸):加NaOH溶液,蒸馏 |
| D、肥皂液(甘油):加食盐搅拌、盐析、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 平行实验编号 | Na2C2O4质量 (m g) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 1.34 | 0.00 | 25.02 |
| 2 | 1.34 | 0.02 | 25.00 |
| 3 | 1.34 | 0.18 | 25.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
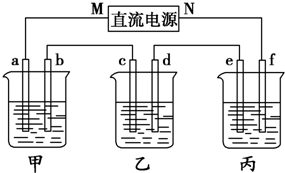 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com