
| A、用亚硫酸钾溶液吸收硫酸工业尾气中的SO2:SO2+SO32-+H20=2HSO3- |
| B、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| C、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |


科目:高中化学 来源: 题型:
A、200mL 1mol/L Al2(SO4)3溶液中,SO
| ||
| B、标准状况下,22.4L Cl2和HCl的混合气体中含分子总数为2×6.02×1023 | ||
C、0.1mol SO
| ||
| D、78g Na2O2与水完全反应后转移电子总数为:2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸的体积增大 |
| B、铝的表面生成致密的薄膜 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠的表面发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17g羟基(-OH)所含有的电子数是9NA |
| B、4.2g C3H6中含有的碳碳双键数一定为0.1NA |
| C、1mol C6H14分子中共价键总数为20 NA |
| D、标准状况下,11.2L CCl4所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氧单质一定含有2NA个氧原子 |
| B、1mol氦气所含的原子数为2NA |
| C、在标准状况下,22.4L乙醇分子个数为NA |
| D、1molMg在空气中完全燃烧生成MgO和Mg3N2的混合物,共失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用惰性电极电解AgNO3溶液:Ag++2H2O═Ag↓+4H++O2↑ |
| B、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| C、铵明矾(AlNH4(SO4)2?12H2O)溶液中加入过量氢氧化钡溶液:Al3++NH4++SO42-+Ba2++5OH-═AlO2-+BaSO4↓+NH3?H2O+2H2O |
| D、碳酸钙溶于过量醋酸:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
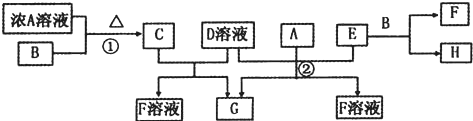
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com