

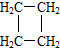 可简写成
可简写成 )
)
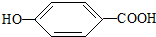 ),其反应方程式为:
),其反应方程式为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O,属消去反应.
+2H2O,属消去反应. 、
、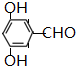 .
.分析 (1)根据结构简式确定分子式;A中含氧官能团名称是羟基、羧基;
(2)羟基、羧基都能与Na反应生成氢气;
(3)A中只有羧基能和NaOH反应;
(4)A在浓硫酸作用下加热发生消去反应生成 ;
;
(5)B的同分异构体符合相邻条件,
①能发生银镜反应,说明含有醛基;
②能使FeCl3溶液显紫色,说明含有酚羟基;
③核磁共振氢谱有4组峰,峰面积比为:1:1:2:2.
解答 解:(1)根据结构简式确定分子式为C7H10O5;A中含氧官能团名称是羟基、羧基,
故答案为:C7H10O5:羟基、羧基;
(2)羟基、羧基都能与Na反应生成氢气,则1molA与足量金属Na反应最多可以产生2mol氢气,其标况下体积为44.8LH2,故答案为:44.8;
(3)A环上的-OH是醇羟基,不能和NaOH、NaHCO3等发生反应,A中含有羧基,具有酸性,可与NaOH发生中和反应,反应的方程式为 ,
,
故答案为: ;
;
(4)A在浓硫酸作用下加热发生消去反应生成 ,
,
反应方程式为 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O,反应类型是消去反应,
+2H2O,反应类型是消去反应,
故答案为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O;消去;
+2H2O;消去;
(5)B的同分异构体符合相邻条件,
①能发生银镜反应,说明含有醛基;
②能使FeCl3溶液显紫色,说明含有酚羟基;
③核磁共振氢谱有4组峰,峰面积比为:1:1:2:2,
符合条件的同分异构体结构简式为 、
、 ,
,
故答案为: 、
、 .
.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,难点是同分异构体种类判断,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
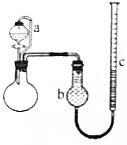 某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:
某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11H、21H、31H、H+和H2是氢元素的五种不同粒子 | |
| B. | 白磷和红磷的相互转化属于物理变化 | |
| C. | 11H和21H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
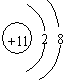 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
| A. | 单质的还原性:G<L<M | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二溴苯只有一种可以证明苯环结构中不存在单双键交替结构 | |
| B. | 可以用分液漏斗分离苯和硝基苯 | |
| C. | 制取一氯乙烷的最佳途径是通过乙烷与氯气反应获得 | |
| D. | 等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
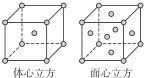
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
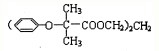 .已知:
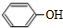
.已知: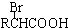 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$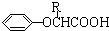
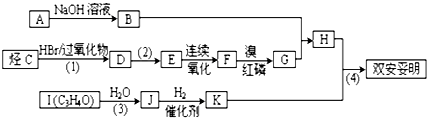
 ,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯.
,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯. .
.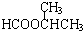 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com