
【题目】研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义。将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(1)。
CH3OCH3(g)+3H2O(1)。
(1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度减小,则反应的焓变△H_____0,熵变△S_______0(分别填“>”、“<”、或“=”)。
(2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示。

①图中0-4min内A的反应速率v(CO2)=________。该温度下平衡常数的表达式为________。
②下列有关说法正确的是______(填字母序号)。
A.反应的活化能大小顺序是:Ea(A)<Ea(B)< Ea(C)
B.升高温度能使反应速率加快,是因为活化分子百分数增大
C.单位时间内消耗CO2与生成H2的数目为3:1时,说明反应已经达到平衡
D.增大压强,平衡正向移动,平衡常数K值增大
(3)某温度下,在体积可变的密闭容器中,改变起始时各物质的起始投料量,在不同的压强下,平衡时生成物二甲醚CH3OCH3(g)的物质的量如下表所示:
序号 | 起始投料量不同的压强下, 平衡CH3OCH3(g)的量不同的压强 | P1 | P2 | P3 |
I | 2.0 molCO2 6.0molH2 | 0.10mol | 0.04 mol | 0.02mol |
II | 1.0molCO2 3.0molH2 | X1 | Y1 | Z1 |
III | 1.0mol CH3OCH3 3.0mol H2O | X2 | Y2 | Z2 |
①P1___P2(填“ >”、“<”或“=”);判断理由为____________。
②X1=______________。
③P2下,III中CH3OCH3的平衡转化率为_____________。
【答案】 < < 1.25 mol·(L·min)-1 ![]() ABC > 压强增大,平衡向正反应方向移动,从而导致生成物的量增大 0.05mol 96﹪
ABC > 压强增大,平衡向正反应方向移动,从而导致生成物的量增大 0.05mol 96﹪
【解析】本题分析:本题主要考查化学平衡。
(1)温度升高时,CH3OCH3(g)的浓度减小,表明平衡左移,则反应的焓变△H<0,该反应是气体物质的量减少的反应,熵变△S<0。
(2) ①图中0-4min内的反应速率v(CO2) =1.25 mol·(L·min)-1。该温度下平衡常数的表达式为![]() 。
。
②A.催化剂通过降低活化能而增大反应速率,反应速率A>B>C,所以反应的活化能大小顺序是:Ea(A)<Ea(B)< Ea(C),故A正确;B.升高温度分子能量升高,活化分子百分数增大,反应速率增大,故B正确;C.单位时间内消耗CO2的反应速率是正反应速率,生成H2的反应速率是逆反应速率,单位时间内消耗CO2与生成H2的数目为3:1时,正反应速率等于逆反应速率,说明反应已经达到平衡,故C正确;D.平衡常数K仅是温度的函数,不随压强的改变而改变,故D错误。故选ABC。
(3) ①P1>P2,判断理由为压强增大,平衡向正反应方向移动,从而导致生成物的量增大。
②P1下,II 相当于I 减压,减压平衡左移,所以X1<0.05mol/L。
③P2下,III与I 等效,CH3OCH3的平衡转化率为1.0-0.04=96%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列液体中,不会出现丁达尔现象的分散系是( )
①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液 ⑤Fe(OH)3溶液 ⑥肥皂水
A.②④B.③④C.②④⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。已知键能数据如下表:
化学键 | N≡N | N—H | H—H |
键能(kJ/mol) | 942 | 391 | b |
反应N2(g)+3H2(g) ![]() 2NH3(g);△H=-93kJ·mol-1。试根据表中所列键能数据计算b数值:( )
2NH3(g);△H=-93kJ·mol-1。试根据表中所列键能数据计算b数值:( )
A.551
B.437
C.558
D.160
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答:

Ⅰ.用图 1 所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是________(填字母序号).
A.石墨 B.铝 C.铂 D.银
(2)N 极发生反应的电极反应式为__________________________________.
Ⅱ.用图 2 所示装置进行第二组实验.实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清. 查阅资料得知,高铁酸根离子(FeO42﹣)在溶液中呈紫红色.
(3)电解过程中,X 极区溶液的 pH________(填“增大”“减小”或“不变”).
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O 若在 X 极收集到672mL 气体,在 Y 极收集到 168mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁 电极)质量减少________g.
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2.该电池负极发生的反应的电极反应式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物的性质叙述不正确的是( )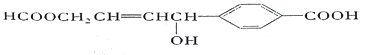
A.1 mol该有机物完全燃烧可生成12molCO2
B.1mol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等
C.1 mol该有机物可以与5mol H2发生加成反应
D.1 mol该有机物可以与2 molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com