
利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是____________(填序号)。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸
d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g)  H2(g)+
H2(g)+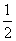 S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算 985 ℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:_______________________________。
②电化学法
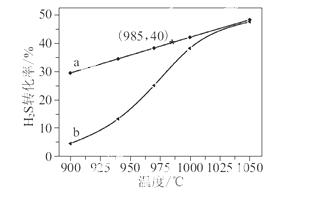
该法制氢过程的示意图如图所示。反应池中反应物的流向采用气、液逆流方式,其目的是
________________________________________________________________________;
反应池中发生反应的化学方程式为_____________________________________________
________________________________________________________________________。
反应后的溶液进入电解池,电解总反应的离子方程式为__________________________________。
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
R、X、Y和Z四种元素,它们常见的化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序正确的是( )
A.R2+ >X2+ >Z2+ >Y2+ B.X2+ >R2+ >Y2+ >Z2+
C.Y2+ >Z2+ >R2+ >X2+ D.Z2+ >X2+ >R2+ >Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
观察下列各物质间的转化图,仔细分析后回答各题。
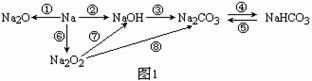
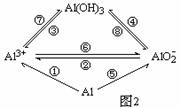
(1)图1中属于氧化还原反应的有_______个,试书写呼吸面具或潜水艇供氧剂分别与H2O和CO2反应的化学方程式: _______________; ______________
(2)若实现图2中①②③④各反应的转化,可加入相同的试剂,其化学式为_________;试写出反应②的离子方程式:______________________________
若实现图2中⑤⑥⑧各转化反应,可加入相同的试剂,其化学式为__________;
氢氧化铝的用途很多,试写出实验室用反应⑦制取氢氧化铝的离子方程式:
_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中加入0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
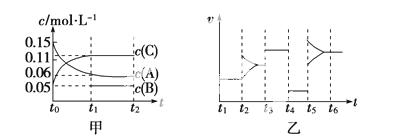
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为________mol/L。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式____________________________________________________。
(3)t3时改变的某一反应条件可能是________(选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
进行如下实验,在A锥形瓶中放入10 g绿豆大小的碳酸钙,在B锥形瓶中放入5 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1盐酸,下图中能正确表示实验结果的是(注:x-时间,y-锥形瓶中碳酸钙减少的质量) ( )
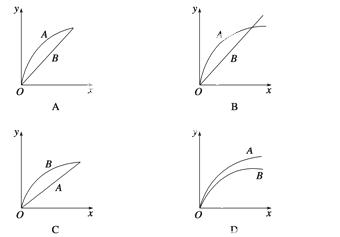
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解原理的说法正确的是( )
①电解是把电能转变成化学能;
②电解是把化学能转变为电能;
③电解质溶液的导电是化学变化,金属的导电是物理变化;
④不能自发进行的氧化还原反应,通过电解原理可以实现;
⑤任何溶液被电解时必然会导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的反应过程和能量变化如图所示,下列有关该反应的叙述
正确的是( )
A. 该反应是吸热反应
B. 反应物的总能量低于生成物的总能量
C. 该反应的反应热△H < 0
D. 加入催化剂后反应放出的热会减少
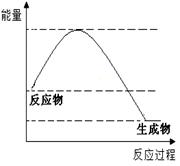
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com