
【题目】碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为____。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是____。
a. 晶体的密度:干冰>冰 b. 晶体的熔点:干冰>冰
c. 晶体中的空间利用率:干冰>冰 d. 晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a. 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b. 晶体中共价键的键长:金刚石中C-C<石墨中C-C
c. 晶体的熔点:金刚石>石墨
d. 晶体中共价键的键角:金刚石>石墨
e. 金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f. 金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为____,一个晶胞中N原子数目为____。
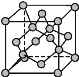
(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为___。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
【答案】![]() g ac ae 正四面体 4 12
g ac ae 正四面体 4 12 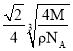
【解析】
本题主要考察晶体结构及相关的计算。
(1)C60属于分子晶体,即其晶胞的构成微粒为C60分子,则一个晶胞中含有C60分子数为:![]() =4,所以一个C60晶胞的质量为:
=4,所以一个C60晶胞的质量为:![]() =
=![]() =
=![]() ;
;
(2)a. 水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,密度比水小,干冰分子之间只存在范德华力,形成的分子晶体是密堆积,密度比水大,故a正确;
b. 冰融化时氢键被破,干冰分子之间只存在范德华力,融化时破坏范德华力,氢键比范德华力强,故晶体的熔点:冰>干冰;且0℃时,水已冻结成冰,而CO2仍为气体,由此可见冰的熔点比干冰高;b错误;
c. 水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,干冰分子之间只存在范德华力,形成的分子晶体是密堆积,晶体中的空间利用率:干冰>冰, c正确;
d. 干冰晶体中只有分子间作用力,冰的晶体中有分子间作用力和氢键,两种晶体中分子间相互作用力类型不同,d错误;
故合理选项为ac;
(3)a. 金刚石的化学键只有碳碳单键,其碳原子的杂化类型为sp3杂化;石墨中的化学键是大π键,可以看成是单双键交替的连接方式,其碳原子的杂化类型为sp2杂化;a正确;
b. 碳碳双键的键长比碳碳单键的短,石墨中的化学键是大π键,,其平均键长要小于金刚石的碳碳单键,b错误;
c. 键长越短,所含能量越高,所以石墨所含能量高,破坏化学键需要较多的能量,所以金刚石的熔点比石墨低,c错误;
d. 金刚石的碳原子的杂化类型为sp3杂化,键角为109°28’;石墨的碳原子的杂化类型为sp2杂化,键角为120°,d错误;
e. 金刚石晶体中只存在共价键,石墨晶体中,碳原子周围连有3个碳原子,这些碳原子之间连有σ键,这样无限扩展,每个6元环都有大π键,这些π电子可以在整个碳层面上活动,类似于金属键;每个碳原子层之间靠范德华力连接,所以石墨晶体中则存在共价键、金属键和范德华力,e正确;
f. 金刚石属于原子晶体,石墨属于混合晶体,f错误;
故合理选项为ae;
(4)B的基态原子的核外价电子排布式为2s22p1,N的基态原子的核外价电子排布式为2s22p3,则B、N周围都可以有三个化学键,即B周围可以连接三个N原子,N原子周围有三个B原子,且题中已经告知BN的结构与金刚石相似,所以B原子周围最近的N原子所构成的立体图形为正四面体;从晶胞的结构来看,有四个“体心”(非正规体心)原子,且和其他原子不同,所以一个晶胞中,含有4个这样的原子,所以不管该原子是B还是N,N原子的数目都是4(原子晶体化学式的下标数字表示原子个数的最简比);
(5)金属铜的晶胞中,晶胞的顶点和面心均含有一个Cu原子,则Cu原子的配位数为12;一个晶胞含有Cu原子个数为:![]() =4,设Cu的原子半径为r cm,则晶胞的棱长为
=4,设Cu的原子半径为r cm,则晶胞的棱长为![]() =
=![]() ,则有
,则有![]() ,解得r=
,解得r=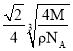 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯分子结构的说法中,错误的是( )
A.各原子均位于同一平面上,6个碳原子彼此连接成为一个平面正六边形的结构
B.苯环中含有3个C—C单键,3个![]() 双键
双键
C.苯分子中6个碳碳键完全相同
D.苯分子中碳碳之间的键是介于单键和双键之间特殊的键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机反应类型有:①取代反应、②加成反应、③消去反应、④酯化反应、⑤加聚反应、⑥氧化反应、⑦还原反应,其中能在有机物中引入羟基的反应类型是
A. ①②③B. ①②⑦C. ⑤⑥⑦D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如右所示。下列关于分枝酸的叙述正确的是( )
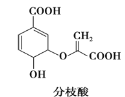
A. 可与乙醇、乙酸反应,且反应类型相同
B. 分子中含有2种官能团
C. 1mol分枝酸最多可与3mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),不能说明此反应达到平衡的标志是( )
2Z(g),不能说明此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的百分含量不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.v正(X)=2v逆(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别放在0.1 molL-1H2SO4溶液中的四块相同的纯锌片,其连接情况如图所示:
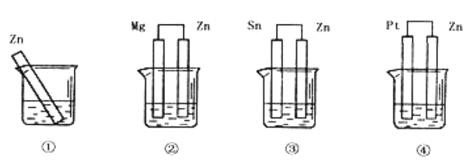
(1)其腐蚀速率由快到慢的顺序是________;
(2)写出②号内正极发生的电极反应式_________;
(3)若③号烧杯内的电解质溶液为NaCl溶液,则Zn电极发生的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有相同电子层数、原子序数相连的三种元素X、Y、Z,最高价氧化物对应水化物的酸性相对强弱是:![]() ,则下列判断正确的是()
,则下列判断正确的是()
A.形成的气态氢化物的稳定性:X<Y<Z
B.原子半径:X>Y>Z
C.原子序数:X>Y>Z
D.得电子能力:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是二氧化氯(ClO2)泡腾片的主要成分。实验室以氯酸钠(NaClO3)为原料先制得ClO2,再制备NaClO2粗产品,其流程如图:
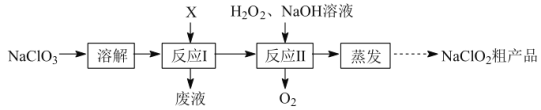
已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为___。
(2)实验在如图-1所示的装置中进行。
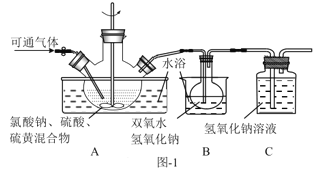
①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为___(填字母)。
②反应Ⅱ中双氧水的作用是___。保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的操作有:装置A中分批加入硫黄、___(写出一种即可)。
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为___(填“减压”、“常压”或“加压”)。
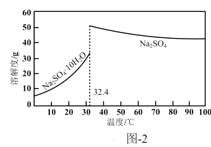
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:___,将滤液进一步处理后排放(实验中须使用的试剂和设备有:CaO固体、酚酞、冰水和冰水浴)。已知:CaSO4不溶于Na2SO4水溶液;Na2SO4的溶解度曲线如图2所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,7.84L甲烷完全燃烧后生成二氧化碳和液态水,同时放出311.4kJ的热量,则甲烷燃烧的热化学方程式是( )
A. CH4+2O2→CO2+2H2O+311.4kJ
B. CH4(g)+2O2(g)→CO2(g)+2H2O(l)+311.4kJ
C. CH4(g)+2O2(g)→CO2(g)+2H2O(l)+889.7kJ
D. CH4(g)+2O2(g)→CO2(g)+2H2O(g)+889.7kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com