
| A. | SO2能漂白纸浆等,故可广泛用于食品的漂白. | |
| B. | 烹调鱼时加入少量料酒和食醋可以减少腥味、增加香味 | |
| C. | 工业上用电解熔融的AlCl3来制取铝单质 | |
| D. | 制作航天服的聚酯纤维和用于光纤通信的光导纤维都是新型无机非金属材料 |
分析 A、SO2具有漂白性,但是有毒,不能用于食品添加剂;
B、烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,是因为料酒中醇和食醋中乙酸发生了酯化反应,生成了有香味的乙酸乙酯;
C、工业上用电解熔融的氧化铝来制取铝单质;
D、根据聚酯纤维和光导纤维的成分分析;
解答 解:A、SO2具有漂白性,但是有毒,不能用于食品添加剂,故A错误;
B、烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,是因为料酒中醇和食醋中乙酸发生了酯化反应,生成了有香味的乙酸乙酯,故B正确;
C、工业上用电解熔融的氧化铝来制取铝单质,AlCl3是共价化合物,而不是电解氯化铝,故C错误;
D、因制作航天服的聚酯纤维属于有机物,故D错误;
故选:B.
点评 本题考查了乙酸乙酯、二氧化硫、氯化铝、聚酯纤维的性质,侧重考查学生对基础知识掌握的熟练程度,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:选择题
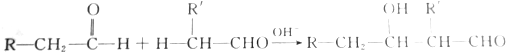
| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol•L-1Na2CO3溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| B. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液中水的电离程度相同 | |
| C. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液中c(Na+):①>②>③ | |
| D. | CH3COONa和CaCl2混合溶液:c(Na-)+2c(Ca-)═c(CH3COO-)+c(CH3COOH)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | SO32- NO3- | C. | CO32- NO3- | D. | CO32-、NO3- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com