
| A. | 1mol/L的醋酸溶液中c(H+)=0.01 mol/L | |
| B. | 醋酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 醋酸溶液的导电性比盐酸的弱 |
分析 强弱电解质的根本区别是电离程度,完全电离的电解质是强电解质、部分电离的电解质是弱电解质,只要能证明醋酸部分电离,在溶液中存在电离平衡,就能证明醋酸是弱电解质,据此分析解答.
解答 解:A.1mol/L的醋酸溶液中c(H+)=0.01 mol/L,氢离子浓度小于醋酸浓度,说明醋酸部分电离,为弱电解质,故A正确;
B.醋酸与水以任意比例互溶,不能说明醋酸部分电离,则不能证明醋酸是弱电解质,故B错误;
C.10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应,说明醋酸是一元酸,但不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故C错误;
D.在相同浓度下,醋酸的导电性比一元强酸溶液的弱,可说明醋酸部分电离,由于没有告诉浓度,则无法判断醋酸是否为弱电解质,故D错误;
故选A.
点评 本题考查弱电解质电离平衡的应用,为高频考点,明确强弱电解质根本区别是解本题关键,浓度未知时不能根据电解质溶液导电性强弱判断电解质强弱,易错选项是B.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2的溶解度最小 | |
| B. | Ca(OH)2的溶解度最小 | |
| C. | AgCl的溶解度最小 | |
| D. | 同一温度下Ksp越大的溶解度也越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 酒精、冰醋酸、草酸钾均为电解质 | |
| D. | NH4SCN、SiO2、NH3•H2O均为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是非金属氧化物 | |
| B. | 都是酸性氧化物,都能与强碱溶液反应 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
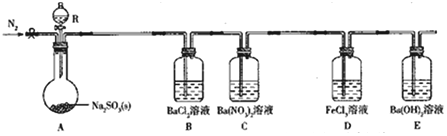
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中,加入铜粉(或BaCl2溶液) | 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
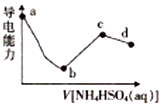 向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )
向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )| A. | b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡 | |
| B. | c 点滚液中:c(H+)+c(NH4+)=c(NH3•H2O)+c(OH-) | |
| C. | ab段反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | bc段之间存在某点,其溶液中:c(NH4+)=2c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com