
分析 K为生成物浓度幂之积与反应物浓度幂之积的比,该反应为放热反应,升高温度平衡逆向移动,K减小,以此来来解答.
解答 解:由CO(g)+2H2(g)?CH3OH(g)可知,K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,由△H<0,可知该反应为放热反应,升高温度平衡逆向移动,K减小,在298K、398K时化学平衡常数分别为K1、K2,则K1>K2,
故答案为:K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;>.
点评 本题考查化学平衡的计算,为高频考点,把握平衡常数的含义、K与温度的关系为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:实验题
 甲苯(
甲苯(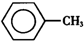 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(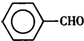 )、苯甲酸(
)、苯甲酸(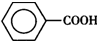 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化性强弱:F2<Cl2 | B. | 金属性强弱:Al<Na | ||
| C. | 酸性强弱:H2CO3<HNO3 | D. | 碱性强弱:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| B. | 该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 使用催化剂或缩小容器体积,该平衡均不会移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]+Cl-+2H2O | |
| B. | 向Na2S2O3溶液中通入足量氯水:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2Cr3++4O2↑+9H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L盐酸等体积混合:AlO2-+4H+=5Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 氨气 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 烧碱 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | 冰醋酸CH3COOH | 胆矾 CuSO4•5H2O | 过氧化钠 | 二氧化硫 |
| D | NH3•H2O | HNO3 | 碳酸钙 | 氧化铁 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
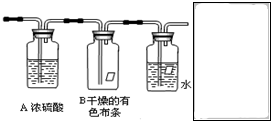 某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com