
| A. | 在标准状况下,2.24L HF中所含有的分子数约为6.02×1022 | |
| B. | 3.2克的Cu与足量的浓硝酸反应生成的气体分子数约为6.02×1022 | |
| C. | 含有6.02×1023个中子的D2O的质量为2.0g | |
| D. | pH=2的硫酸氢钠溶液中的硫酸根离子数约为6.02×1021 |
分析 A、标况下HF为液体;
B、求出铜的物质的量,然后根据铜反应后变为+2价,而浓硝酸被还原为+4价,根据得失电子数守恒来计算;
C、重水中含10个中子,根据中子的个数求出重水的物质的量,从而求出质量;
D、溶液体积不明确.
解答 解:A、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、3.2g铜的物质的量为0.05mol,而铜反应后变为+2价,故0.05mol铜反应失去0.1mol电子,而浓硝酸被还原为NO2,即氮元素由+5价变为+4价,设生成的NO2的物质的量为xmol,则有:xmol×(5-4)=0.1mol,解得x=0.1mol,而NO2中存在平衡:2NO2?N2O4,导致分子个数减少,则最终分子个数小于0.1NA个,故B错误;
C、重水中含10个中子,即1mol重水中含10mol中子,则含6.02×1023个中子的D2O的物质的量为0.1mol,则质量m=nM=0.1mol×20g/mol=2g,故C正确;
D、溶液体积不明确,故溶液中的硫酸根离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | 若物质的量浓度相同的NH4Cl和NH3•H2O混合溶液pH>7,则在pH=7的NH4Cl和NH3•H2O混合溶液中:c(NH4+)>c(NH3•H2O) | |
| C. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3) | |
| D. | 0.1mol/LNa2CO3溶液和0.1mol/LNaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
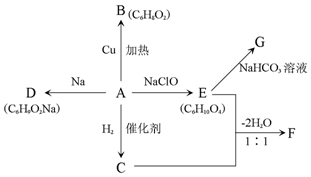
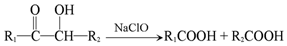

 反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.
反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | d1>d2 | C. | bω2≥aω1 | D. | a d1ω1=b d2ω2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系的分类 | |
| B. | Fe与Cl2反应的产物 | |
| C. | 向AlCl3溶液滴加NaOH溶液后铝的存在形式 | |
| D. | Na与O2反应的产物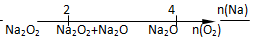 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量使用含磷洗涤剂会引发潮汐 | |
| B. | 减少使用氟氯代烃的目的是减少酸雨 | |
| C. | 大量开采地下水,矿产资源,以满足社会经济发展的需求 | |
| D. | 氢燃料电池汽车的使用,可以有效减少城市空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液A和B均可以是盐酸或NaOH溶液 | |
| B. | 若溶液B选用浓H2SO4,反应条件需要加热,剩余固体为铝 | |
| C. | 溶液A和B均不可选用稀HNO3 | |
| D. | 实验室中方案Ⅱ更容易实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取少量蒸馏水 | B. | 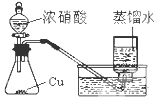 制取少量NO2 | ||
| C. |  比较MnO2、Cl2、I2的氧化性 | D. |  量取8.50mL的 稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CO2气体产生蓝色沉淀 | |
| B. | 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| C. | 与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| D. | 与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com