
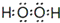 ;
;分析 A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大.A和E最外层电子数相同,二者同主族,短周期主族元素的原子中,E原子的半径最大,则E为Na;B、C和F在周期表中相邻,B、C同周期,C、F同主族,则B、C处于第二周期,F处于第三周期,F原子的质子数是C原子质子数的2倍,则C为O元素、F为S元素,可知B为N元素;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),则A为H元素,X为H2O、Y为H2O2;D形成的分子为单原子分子,且原子序数介于氧、钠之间,故D为Ne元素;G的原子序数大于硫,故G为Cl,据此解答.
解答 解:A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大.A和E最外层电子数相同,二者同主族,短周期主族元素的原子中,E原子的半径最大,则E为Na;B、C和F在周期表中相邻,B、C同周期,C、F同主族,则B、C处于第二周期,F处于第三周期,F原子的质子数是C原子质子数的2倍,则C为O元素、F为S元素,可知B为N元素;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),则A为H元素,X为H2O、Y为H2O2;D形成的分子为单原子分子,且原子序数介于氧、钠之间,故D为Ne元素;G的原子序数大于硫,故G为Cl.
(1)Y为H2O2,电子式为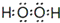 ,故答案为:
,故答案为: ;
;
(2)Y为H2O2,被K2Cr2O7氧化为氧气,反应的离子方程式是Cr2O72-+3H2O2+8H+=2Cr3++3O2+7H2O,
故答案为:Cr2O72-+3H2O2+8H+=2Cr3++3O2+7H2O;
(3)A、C、E组成的化合物的水溶液为NaOH溶液,金属易拉罐含铝,则发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)P和Q两种物质都是由H、O、Na、S四种元素组成的盐,其水溶液都显酸性,两物质为NaHSO3、NaHSO4,等物质的量的P和Q恰好完全反应,该反应的离子方程式:H++HSO3-═SO2↑+H2O,硫酸氢钠和亚硫酸氢钠中均含有离子键和共价键,
故答案为:H++HSO3-═SO2↑+H2O;离子键和共价键;
(5)由A、B两元素形成的化合物W,一个W分子和一个Y分子中都含有18个电子,则W为N2H4,W与Y的反应方程式为:N2H4+2H2O2=N2+4H2O,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8KJ热量,该反应热化学方程式为:N2H4 (1)+2H2O2(1)=N2(g)+4H2O(1)△H=-817.6 kJ•mol-1,
故答案为:N2H4 (1)+2H2O2(1)=N2(g)+4H2O(1)△H=-817.6 kJ•mol-1.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,注意对元素化合物知识的掌握,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
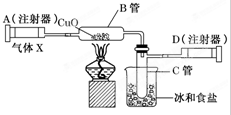 如图所示的实验装置可用来测定含两种元素的气体X的分子式.
如图所示的实验装置可用来测定含两种元素的气体X的分子式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2既是氧化剂,又是还原剂 | |
| B. | O2是还原产物,Mn2+是氧化产物 | |
| C. | 通常用浓盐酸酸化高锰酸钾溶液 | |
| D. | 标准状况下,产生22.4 L O2时反应转移2 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
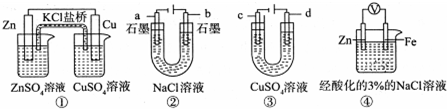
| A. | 装置①中,盐桥中的 K+移向CuSO4溶液 | |
| B. | 装置②在电解过程中,a极上得到22.4 L气体(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) | |
| C. | 可以用装置③在铜上镀银,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
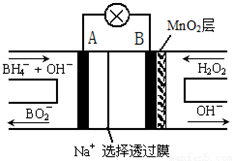
| A. | 放电过程中,正极附近溶液中的H+浓度减小 | |
| B. | 电池正极区的电极反应为:BH${\;}_{4}^{-}$+8OH--8e-=BO$_2^-$+6H2O | |
| C. | 放电过程中,Na+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 0.1mol•L-1的KHA溶液,其PH=10:c(K+)>c(OH-)>c(HA-)>c(H+) | |
| C. | 20mL0.1mol•L-1醋酸钠溶液与10mL 0.1mol•L-1盐酸混合后的溶液中: 2 c(H+)+c(CH3COOH)=c(CH3COO-)+2 c(OH-) | |
| D. | 在25mL 0.1 mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化如图所示,在A、B间任一点,溶液中一定都存在下列关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)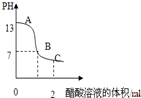 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH2与HBr | B. | 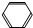 -CH3与混酸(浓HNO3和浓H2SO4,30℃) -CH3与混酸(浓HNO3和浓H2SO4,30℃) | ||
| C. | CH3CH═CHCH3与HBr | D. | 光照条件下CH3CH3与Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2 596.6 kJ•mol-1,则2 mol C2H2(g)完全燃烧生成气态水时放出的热量大于2 596.6 kJ | |
| B. | 1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,则其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1; ②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1. 则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com