
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
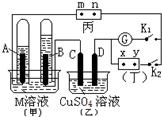 如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:
如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通过Na2O2使其增重b g时,反应中转移电子数为bNA/44 | |
| B. | 18 g D2O中含有质子的数目为NA | |
| C. | 12 g C3H6 与 16 g C2H4的混合物完全燃烧,可生成CO2分子数为2 NA | |
| D. | 0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成 0.1 NA个胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极板上覆盖有PbO2,负极板上覆盖有Pb | |
| B. | 该电池放电时的正极反应为PbO2(s)+4H+(aq)+SO2-4(aq)+2e-═PbSO4(s)+2H2O(l) | |
| C. | 该电池充电时,两个电极上都有PbSO4生成 | |
| D. | 用该电池电解饱和食盐水制氯气,若制得0.050molCl2,这时电池内消耗H2SO40.10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 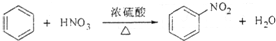 | |
| B. |  | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{?}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
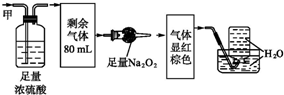
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的平均分子量不再变化 | B. | 反应的平衡常数不变 | ||
| C. | ?(H2)=2 ?(HI) | D. | 气体的颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com