
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 | |
| C. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
分析 A.平衡时c(PCl5)=0.4mol/L,结合反应可知转化的△c(Cl2)=0.4mol/L,结合v=$\frac{△c}{△t}$计算;
B.△H<0,为放热反应,升高温度,平衡逆向移动;
C.c2=1.0mol/L-0.4mol/L=0.6mol/L,可知平衡时氯气的物质的量为0.6mol/L×2L=1.2mol;
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,物质的量减少一半,压强减小,平衡逆向移动.
解答 解:A.平衡时c(PCl5)=0.4mol/L,结合反应可知转化的△c(Cl2)=0.4mol/L,10 min内,v(Cl2)=$\frac{0.4mol/L}{10min}$=0.04 mol/(L•min),故A正确;
B.△H<0,为放热反应,升高温度,平衡逆向移动,则K减小,平衡时PCl3的转化率减小,故B错误;
C.c2=1.0mol/L-0.4mol/L=0.6mol/L,可知平衡时氯气的物质的量为0.6mol/L×2L=1.2mol,则当容器中Cl2为1.2 mol时,反应达到平衡,故C正确;
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,物质的量减少一半,压强减小,平衡逆向移动,则相同条件下再达平衡时,c(PCl5)<0.2 mol/L,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握平衡影响因素、K与温度有关、速率计算为解答的关键,侧重分析与计算能力的考查,选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ag2SO4 | FeS | CuS | Ag2S | |
| Ksp | 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
| A. | 相同温度下,Ag2SO4、FeS、CuS饱和溶液中:c(Cu2+)>c(Fe2+)>c(Ag+) | |
| B. | 向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:S2-+Cu2+=CuS↓ | |
| C. | 浓度均为0.004mol•L-1的AgNO3和H2SO4溶液等体积混合后不能产生沉淀 | |
| D. | 向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.
如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
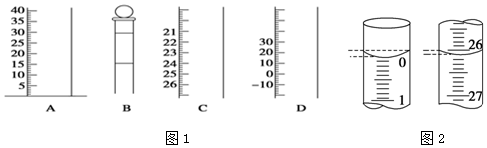
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
| 第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
| 第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com