
| A.用纯锌和稀硫酸反应 | B.用含铜等的粗锌和稀硫酸反应 |
| C.用纯锌和浓硫酸反应 | D.用含铜等的粗锌和稀硝酸反应 |
科目:高中化学 来源:不详 题型:单选题
| A.制Cl2:MnO2、盐酸(浓) | B.制H2:硫酸(稀)、Zn |
| C.制O2: MnO2、H2O2 | D.制CO2:硫酸(稀)、CaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
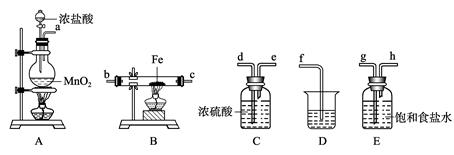
 _________________________________。
_________________________________。 _________________________。
_________________________。 ;
;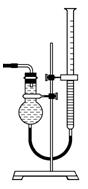
 图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。 会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
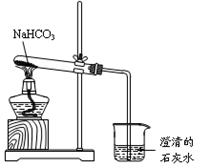
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
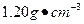 )配制100 mL 0.200
)配制100 mL 0.200 硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先 ,再用来量取所需的硫酸。
硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先 ,再用来量取所需的硫酸。 的硫酸溶液测定氢氧化钠样品中杂质氯化钠的含量。
的硫酸溶液测定氢氧化钠样品中杂质氯化钠的含量。| 实验编号 | 滴定开始时滴定管的读数为 | 滴定完成时,滴定管的读数为 | 待测溶液的体积 (mL) |
| 1 | 0.07 | 22.59 | 20.00 |
| 2 | 0.22 | 22.72 | 20.00 |
| 3 | 0.35 | 22.83 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
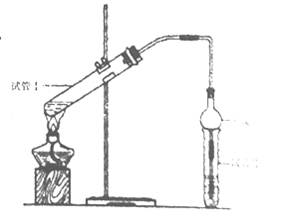
| 实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中的试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2 mL乙酸、1 mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
| C | 3 mL乙醇、2 mL乙酸、6 mL 3mol/L硫酸 | 1.2 | |
| D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com