
在室温下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量CH3COONa固体 B. 通入少量氯化氢气体
C. 升高温度 D. 加入少量氢氧化钠固体
科目:高中化学 来源: 题型:
X、Y两种元素的原子的质子数之和为20,两元素形成的化合物在水溶液中能电离出电子层结构相同的阴、阳离子,则X、Y形成的化合物是( )
A.MgF2 B.NaF
C.LiCl D.Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.2 g
C.4.4 g D.在2.2 g和4.4 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:W<X<Y<Z
B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z
D.元素的最高化合价:W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,a mol.L-1一元酸HA与b mol.L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
A.a = b B.a > b C.c(A-) = c(Na+) D.c(A-) < c (Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,离子的物质的量浓度关系正确的是( )
A.pH=4的醋酸中:c(H+)= 4.0 mol·L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+) = c(Cl-)+ c(OH-)
D.pH=12的纯碱溶液中:c(OH-)= 1.0×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验研究中经常用到定量分析。
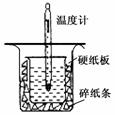 I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
(1)从右图实验装置看,装置中的一个明显错误是
。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值
会_________,(填“偏大”、“偏小”、“ 不变”)
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55 mol·L-1NaOH 溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由 。
Ⅱ.某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
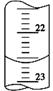 请回答:
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致
测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:________________,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究。
 (1)根据右图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。实验中使用肥皂液检验的产物是 ;图中湿棉花的作用是 ;铁粉与水蒸气反应的化学方程式是 。
(1)根据右图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。实验中使用肥皂液检验的产物是 ;图中湿棉花的作用是 ;铁粉与水蒸气反应的化学方程式是 。
(2)甲同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
(查阅资料可知:Fe3O4 + 8HCl(浓)  FeCl2 + 2FeCl3 + 4H2O)
FeCl2 + 2FeCl3 + 4H2O)
| 实验序号 | 实验操作 | 实验现象 |
| ① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产 生,溶液呈浅绿色。 |
| ② | 向上述烧杯中滴加几滴KSCN溶 液,充分振荡 | 溶液没有出现红色 |
根据上述实验现象,不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是 (填化学式);
(3) 乙同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
| 实验序号 | 实验操作 | 实验现象 |
| ① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
| ② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
| ③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
根据乙同学的实验现象和数据,残留黑色固体中Fe3O4的质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
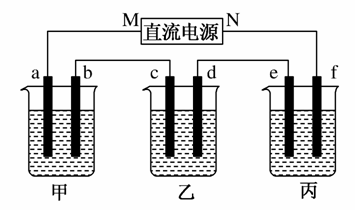
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,②中c电极质量增加。据此回答问题:
(1)电源的N端为________极;
(2)电极b上发生的电极反应为__________________________;
(3)列式计算电极b上生成的气体在标准状况下的体积:_______
_________________________________________________________;
(4)电极c的质量变化是________g;
(5)电解前后各溶液的酸、碱性大小是否发生变化,并简述其原因:
①溶液_______________________________________________;
②溶液_______________________________________________;
③溶液_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com