
| A. | 通入稀有气体使压强增大,平衡将正向移动 | |
| B. | 增大Y的物质的量,X的转化率增大 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
分析 A、化学平衡恒容恒温条件,加入惰气总压增大,分压不变,平衡不动;
B、增加Y的物质的量,平衡将正向移动;
C、降温平衡正向进行,气体质量不变,物质的量减小,结合M=$\frac{m}{n}$判断;
D、根据平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比等于系数之比.
解答 解:A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变,平衡不移动,故A错误;
B、增加Y的物质的量,平衡将正向移动,X的转化率增大,故B正确;
C、降低温度平衡向正反应移动,反应混合气体总的物质的量减小,混合气体总质量不变,结合M=$\frac{m}{n}$知混合气体的平均摩尔质量增大,故C错误;
D、平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比等于系数之比即m:n,故D错误;
故选B.
点评 本题考查化学平衡移动的影响因素、化学平衡状态的判断等,难度中等,A为易错点,注意压强的变化不能引起浓度的变化化学平衡不移动,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题

 C6H5COOCH3+H2O.
C6H5COOCH3+H2O.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
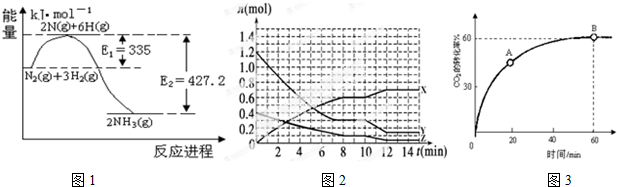
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
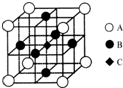 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2 | |
| B. | 使用高效催化剂可有效增大正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、胆矾都是混合物 | |
| B. | 烧碱、纯碱都是离子化合物 | |
| C. | 二氧化碳、二氧化氮都是酸性氧化物 | |
| D. | 水、氨水都是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饮用水越纯净对人体越有益 | |
| B. | 调味剂和营养剂加得越多越好 | |
| C. | 垃圾分类有利于资源回收利用,废易拉罐不是有害垃圾,可回收利用 | |
| D. | 为消除碘缺乏症,卫生部规定必须在食盐中加碘单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com