
 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ③ | 1.2g | 无其他物质 | a |
| ④ | 1.2g | CuO 0.5g | b |
| ⑤ | 1.2g | MnO2 0.5g | c |
 ,
, ;
;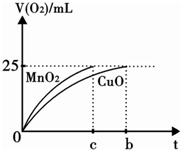 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存 |
B、 向O.1mo1-L-1该物质的溶液中清加0.Lmol-1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示 |
| C、检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 |
| D、向该物质的溶液中摘加Ba(OH)2溶液,恰好使S042-完全沉淀的离子方程式为:Fe2++2SO42-+3Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴离子的还原性按X、Y、Z的顺序增强 |
| B、单质的氧化性按X、Y、Z的顺序减弱 |
| C、元素的非金属性按X、Y、Z的顺序增强 |
| D、电负性按X、Y、Z的顺序减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol NH3 |
| B、标准状况下22.4 L He |
| C、4℃时 9 mL 水 |
| D、0.2 mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 热化学方程式 | 评价 | |
| A | 已知H+(aq)+OH-(aq)═H2O(l) △H=-57.3 kJ?mol-1,将稀硫酸与稀氢氧化钡溶液混合 | H2SO4(aq)+Ba(OH)2(aq) ═BaSO4(s)+2H2O(l) △H=-114.6 kJ?mol-1 | 正确 |
| B | 醋酸与稀氢氧化钠溶液混合 | CH3COOH(aq)+NaOH(aq) ═NaCl(aq)+H2O(l) △H=-57.3kJ?mol-1 | 不正确;因为醋酸状态为“aq”,而不是“l”. |
| C | 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ | SO3(g)+H2O(l)═H2SO4(aq) △H=-130.3 kJ?mol-1 | 不正确;因为反应热为△H=-260.6kJ?mol-1 |
| D | 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ | C(s)+O2(g)═CO2(g) △H=-393.51 kJ?mol-1 | 不正确;同素异形体要注名称:C(石墨) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com