
【题目】标准状态下,将11.2 LHCl气体溶于水,制成250mL溶液。
(1)试求该盐酸溶液的物质的量浓度______;
(2)如果用质量分数为36.5%密度为1.2 g/cm3 的浓盐酸来配制上述溶液,则应量取该浓盐酸多少毫升进行稀释____________。
【答案】2 mol·L-141.7mL
【解析】
(1).先由n=![]() 计算HCl的物质的量,再利用c=
计算HCl的物质的量,再利用c=![]() 计算HCl的物质的量浓度;(2).根据稀释定律c1V1=c2V2计算。
计算HCl的物质的量浓度;(2).根据稀释定律c1V1=c2V2计算。
(1).在标准状况下,11.2LHCl的物质的量为n(HCl)=11.2L÷22.4L/mol=0.5mol,则该盐酸溶液的物质的量浓度为c(HCl)=0.5mol÷0.25L=2 mol·L-1,故答案为:2 mol·L-1;
(2). 质量分数为36.5%、密度为1.2 g/cm3的浓盐酸的物质的量浓度为:c(HCl)=![]() =
=![]() =12mol/L,用该浓盐酸配制250mL、2mol/L的稀盐酸,设需量取该浓盐酸的体积为a L,则根据稀释定律有:a L×12mol/L=0.25L×2mol/L,解得a=41.7mL,故答案为:41.7mL。
=12mol/L,用该浓盐酸配制250mL、2mol/L的稀盐酸,设需量取该浓盐酸的体积为a L,则根据稀释定律有:a L×12mol/L=0.25L×2mol/L,解得a=41.7mL,故答案为:41.7mL。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是( )

A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下有以下四种气体:
①6.72 L CH4 ②3.01×1023个HCl分子 ③2.404×1023个H2S分子 ④0.2 mol NH3
a.物质的量由小到大的顺序_____________________________________
b.质量由小到大的顺序_________________________________________
(2)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
(3)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中:混合气体的平均相对分子质量是________,对氢气的相对密度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中不正确的是
A. 量取100 mL,该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有29.25 g NaCl
C. 配制100 mL该溶液,用托盘天平称5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO 易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5; [Cu(NH3)2]Ac 溶液用于除去CO的化学反应方程式:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3] Ac·CO (式中Ac-代表醋酸根)。请回答下列问题:
(1)C、N、O的第一电离能最大的是_____________,原因是___________________________。基态Fe 原子的价电子排布图为___________________________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_____________,羰基铁的结构如图,根据该图可知CO作为配位体是以__________原子为配位原子与Fe原子结合。

(3)离子水化能是气态离子溶于大量水中成为无限稀释溶液时释放的能量。离子在溶液中的稳定性可以从离子的大小、电荷、水化能等因素来解释。Cu2+和Cu+的水化能分别是-2121kJ·mol-1和-582 kJ·mol-1,在水溶液里Cu2+比Cu+稳定的原因是_______________________________。[Cu(NH3)2]+在水溶液中相对稳定,在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是________________________________。
(4)用[Cu(NH3)2]Ac除去CO的反应中,肯定有形成________________。
a.离子键 b.配位键 c.非极性键 d. σ键
(5)钙铜合金的晶体结构可看成(a) (b) 两种原子层交替堆积排列而成图(c),则该合金六方晶胞(即平行六面体晶胞)中含为Cu________个。已知同层的Ca-Cu的距离为294pm,根据图示求同层相邻Ca-Ca的距离__________pm (已知![]() =1.73 计算结果保留整数)。
=1.73 计算结果保留整数)。
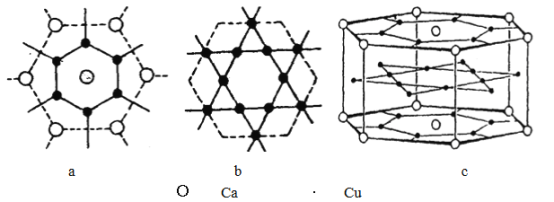
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃某二元碱B(OH)2水溶液中,B2+、B(OH)+和B(OH)2三者各自的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是(已知多元碱的电离是逐级进行的)
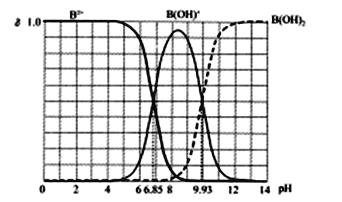
A. Kb2[B(OH)2]的数量级为10-8
B. 在B(OH)Cl溶液中c(OH-)>c(H+)
C. 等物质的量的BCl2和B(OH)Cl混合溶液中δ(B2+)<δ[B(OH)+]
D. B(OH)Cl溶液中,若c[B(OH)2]+2c(B2+)+c(H+)-c(OH-),则δ[B(OH)2]=δ[B(OH)+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入lmolX和2molY,发生下列反应:X(g)+2Y(g)![]() M(g)+2N(g) △H=akJ/mol(a>0),下列说法中正确的是
M(g)+2N(g) △H=akJ/mol(a>0),下列说法中正确的是
A. 到达平衡状态时,加入催化剂,平衡不移动,反应速率也不会发生改变
B. 反应达到平衡时,X和Y的转化率相等
C. v正(X)=2v逆(N)时,反应到达平衡状态
D. 到达平衡状态时,反应吸收akJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com