
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| C. | 在石油分馏的实验中,需要在蒸馏烧瓶中加入碎瓷片 | |
| D. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 |
分析 A.碳酸氢钠分解生成水;
B.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性;
C.蒸馏时,加入碎瓷片可防止液体暴沸;
D.水银汞不溶于水,可以和硫单质反应.
解答 解:A.碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故A错误;
B.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故B错误;
C.通常我们会在蒸馏烧瓶中加入少量碎瓷片或者沸石,形成溶液的爆沸中心,防止液体爆沸,故C正确;
D.温度计摔坏导致水银散落到地面上,汞不溶于水,不能用水冲洗掉,应立即撒上硫粉,故D错误.
故选C.
点评 本题考查化学实验安全及事故处理,把握物质的性质、实验基本技能、实验安全常识等为解答的关键,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、稀硫酸组成原电池,其负极反应式为 Al-3e-═Al3+ | |
| B. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为 Cu-2e-═Cu2+ | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为 Cu-2e-═Cu2+ | |
| D. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为 Al-3e-+4OH-═AlO${\;}_{2}^{-}$+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:S2->K+>Na+ | |
| B. | 氢化物的沸点:HI>HBr>HF | |
| C. | 固体的热稳定性:Na2CO3>CaCO3>NaHCO3 | |
| D. | 相同物质的量浓度的下列溶液中NH4+的浓度:(NH4)2Fe(SO4)2>NH4Cl>NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验 | 操作 |
| A | 测定次氯酸钠的pH | 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,变色后,与标准比色卡对比 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴快速流出 |
| D | 取出分液漏斗中所需的上层液体 | 将下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,从分液漏斗下端管口继续放出下层液体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含一个叁键的直链有机物 | B. | 含有两个双键的直链有机物 | ||
| C. | 含一个双键的环状有机物 | D. | 只含单键且两个环的环状有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL 0.1mol•L-1醋酸与中和100mL 0.01mol•L-1的醋酸所需同种碱溶液的量不同 | |
| B. | 常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 | |
| C. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 | |
| D. | 常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
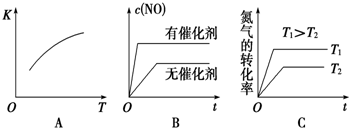
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4mol•L-1•min-1 | |
| B. | 用B表示的反应速率是0.3mol•L-1•min-1 | |
| C. | 2min末时的反应速率,用B表示为0.3mol•L-1•min-1 | |
| D. | 在这2min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a=b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com