
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
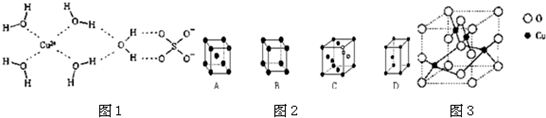
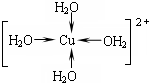 ;Cu为面心立方密堆积,配位数为12,故C符合;
;Cu为面心立方密堆积,配位数为12,故C符合; ;C;
;C;| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
| 6+2-2×4 |
| 2 |


科目:高中化学 来源: 题型:
| A、离子半径的大小顺序为W>Q>Z>X>Y |
| B、元素X的气态氢化物与Q的单质可发生置换反应 |
| C、元素X与Y可以形成5种以上的化合物 |
| D、元素Z、W、Q的单质在一定条件下均能和强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去N2中的少量O2,可通过灼热的Cu网后,收集气体 |
| B、除去FeCl3溶液中Fe(OH)3沉淀可以过滤 |
| C、重结晶不能用于提纯物质 |
| D、除去KCl中的K2CO3加适量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:
某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:查看答案和解析>>
科目:高中化学 来源: 题型:
 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
 (g)
(g)| Pt-Sn/Al2O3 |
| 高温 |
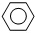 (g)+3H2(g)
(g)+3H2(g)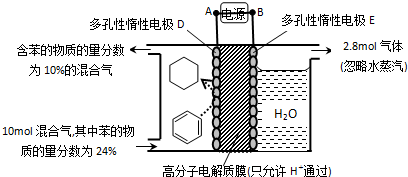
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
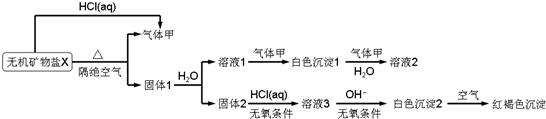
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com