
| A.以焦炭和水制取水煤气后分离出氢气 |
| B.用铁、锌等活泼金属与稀硫酸制取氢气 |
| C.由火力发电厂提供电力电解水产生氢气 |
| D.利用高效催化剂和太阳能使海水分解产生氢气 |
科目:高中化学 来源:不详 题型:单选题
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.海水蒸发制粗盐的过程中只发生了化学变化 |
| C.工业上可用电解MgCl2溶液的方法来制备Mg |
| D.从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
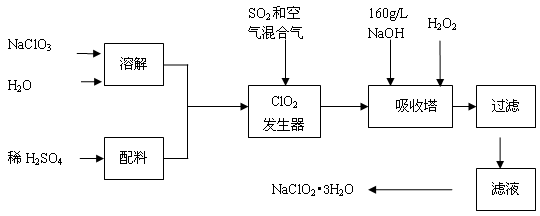
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
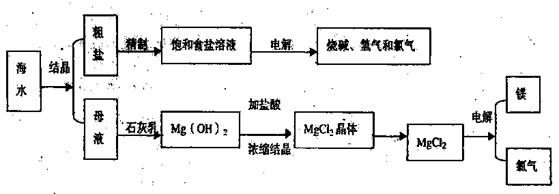
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
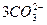 ====
====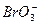 +5Br-+3CO2↑;③
+5Br-+3CO2↑;③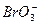 + 5Br-+6H+====3Br2+3H2O。其中反应②中的氧化剂是_________________;还原剂是_________________。
+ 5Br-+6H+====3Br2+3H2O。其中反应②中的氧化剂是_________________;还原剂是_________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.聚乙烯是天然高分子材 | B.所有的橡胶都是天然高分子材料 |
| C.钢化玻璃和玻璃钢是同种材料 | D.高分子分离膜是具有特殊分离功能的高分子材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);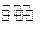 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。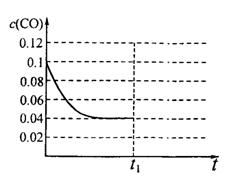
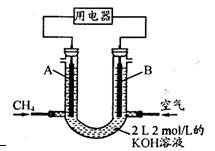
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
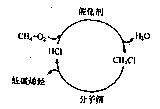
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com