
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
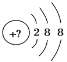
(1)该微粒是中性微粒,这种微粒的符号是________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是________。
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示(球的大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中正确的是( )。
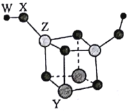
A.W和X可以组成原子个数比为2:1和1:1的离子化合物
B.工业上可采用电解Z的熔融氯化物的方法制得单质Z
C.Z的最高价氧化物对应水化物的碱性比Y的强
D.X、Y、Z三种元素的离子半径由小到大顺序为Z<Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁过程中涉及到的主要反应有:
i.C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
ii.C(s)+CO2(g)=2CO(g)△H2=+172kJ/mol
iii.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H3
2Fe(s)+3CO2(g)△H3
iv.2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g)△H4=+460kJ/mol
4Fe(s)+3CO2(g)△H4=+460kJ/mol
回答下列问题:
(1)反应iv_________(填“能”或“不能”)在任何温度下自发进行。
(2)△H3=_________kJ/mol。
(3)T1时,向容积为10L的恒容密闭容器中加入3molFe2O3和3molCO发生反应iii,5min时达到平衡,平衡时测得混合气体中CO2的体积分数为80%。
①0~5min内反应的平均速率v(CO2)=_________molL-lmin-l。
②该温度下反应的平衡常数为_________。
③若将平衡后的混合气体通入1L3.6mol/L的NaOH溶液,恰好完全反应,反应的离子方程式为_________,所得溶液中离子浓度由大到小的顺序是_________
④下列选项中能够说明该反应已经达到平衡状态的是_________(填序号)。
a.Fe2O3的物质的量不再变化
b.体系的压强保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO和生成CO2的物质的量相等
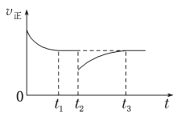
(4)一定条件下进行反应iii,正向反应速率与时间的关系如图所示,t2时刻改变了一个外界条件,可能是_________。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在反应:As2S3(s)+3S2-(aq)2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷在元素周期表中的位置为_______;AsH3的电子式为______;
(2)下列说法正确的是_________;
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.第一电离能:S<P<As
(3)沉淀X为__________(填化学式);
(4)“一级沉砷”中FeSO4的作用是________。
(5)“二级沉砷”中H2O2与含砷物质反应的化学方程式为__________;
(6)关于地下水中砷的来源有多种假设,其中一种认为富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成![]() ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的电子气体有BCl3、N2O、SiH4及SiHCl3等。回答下列问题:
(1)气体B2H6与氯气混合可生成气态BCl3,每生成1.0 g BCl3放出5.9 kJ的热量,该反应的热化学方程式为______。
(2)25℃时反应 S(s) +H2(g)H2S(g) Kp1=6.0×105
Si(s)+2H2(g)SiH4(g) Kp2=7.8×106
则反应 Si(s)+2H2S(g)SiH4(g)+2S(s) Kp=_____(Kp为以分压表示的平衡常数,下同)。
(3)多晶硅制中发生一系列反应:
(I)4SiHCl3(g)Si(s)+3SiCl4(g)+2H2(g) △H1=a kJ /mol
(II)SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) △H2=b kJ/mo1
(III)SiCl2(g)+H2(g)Si(s)+2HCl(g) △H3=c kJ/mo1
①反应SiHCl3 (g)SiCl2 (g) +HCl (g) △H=____kJ/mo1 (用含a、b、c的代数式表示)
②反应(I)(II)(III)的Kp与温度的关系如下图

属于吸热反应的是_________(填I、II或III);图中M点分压间满足关系:p(SiCl4)=______(用相关物质的分压p表示)。
(4)一种制取N2O的方法为 O2NNH2(aq)→N2O(g)+H2O(1),该反应的历程如下:
(I)O2NNH2(aq)![]() O2NNH-(aq) +H+(aq) (快速平衡)
O2NNH-(aq) +H+(aq) (快速平衡)
(II)O2NNH-(aq)![]() N2O(g) +OH-(aq) (慢)
N2O(g) +OH-(aq) (慢)
(III)H+(aq)+OH-(aq)![]() H2O(1) (快)
H2O(1) (快)
①活化能最大的反应步骤是_________(填I、II或III)。
②已知反应(I)的速率方程v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),(k1、k -1分别为正逆反应速率常数,反应(I)达到平衡时,平衡常数K=__________(用k1、k -1表示)。
③已知总反应速率方程为v=K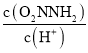 ,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯具有类似茉莉花香的气味,可以用甲苯和乙醇进行人工合成,其合成路线如图:
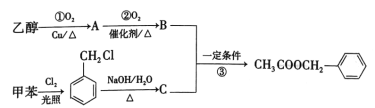
(1)写出反应①的化学方程式:___。
(2)反应③的反应类型为___。
(3)反应__(填序号)的原子利用率为100%,符合绿色化学的要求。
(4)C的结构简式为__,试写出C的另外两种不同类别的芳香类同分异构体的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:

(1)定性如图甲可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______。
(2)定量用图乙所示装置做对照试验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com