
| A. | 3:7 | B. | 7:1 | C. | 5:3 | D. | 1:1 |
分析 可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,
若剩余气体为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,以此解答该题.
解答 解:NO2和O2与水的反应属于循环反应,可简化为:4NO2+O2+2H2O=4HNO3,对该反应来说,若NO2剩余,则实际是NO,由3NO2+H2O=2HNO3+NO可知,剩余NO气体是5mL,说明剩余的NO2为:5mL×3=15mL,其余的25mL气体中V(NO2):V(O2)=4:1,则混合气体中氧气的体积为:25mL×$\frac{1}{5}$=5mL,二氧化氮的体积为:40mL-5mL=35mL,则原混合气体中NO2和O2体积比为:35mL:5mL=7:1;
若剩余气体是O2,则反应的35mL中V(NO2):V(O2)=4:1,原混合气体中二氧化氮的体积为:35mL×$\frac{4}{5}$=28mL,氧气为:40mL-28mL=12mL,
则原混合气体中NO2和O2体积比为:28mL:12mL=7:3,
故选B.
点评 本题考查了氮氧化物的性质、混合物有关计算,为高频考点,题目难度中等,关键是分析剩余气体的成分,再根据反应的方程式计算,试题培养了学生的分析及化学计算能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
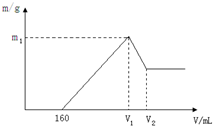 将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
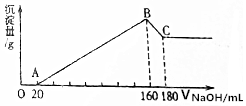 将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.
将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②④⑦ | C. | ④⑥⑦ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液,可制得金属镁 | |
| B. | 测定氢氧化钠是离子化合物时,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| C. | 向FeCl3溶液中加入Mg粉,可观察到有气泡产生 | |
| D. | 在某钠盐溶液中加入澄清石灰水,若有白色沉淀生成,则该钠盐一定是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
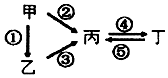 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | S | H2S | SO3 | H2SO4 |
| C | N2 | NH3 | NO | NO2 |
| D | Si | SiO2 | Na2SiO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | 碳棒 | Cu | Zn | Mg |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | NaCl | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com