
| A. | H2O | B. | CaCl2 | C. | KOH | D. | Cl2 |
科目:高中化学 来源: 题型:实验题
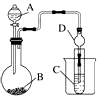
 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
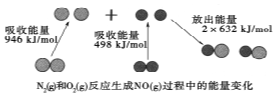 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 在1L的容器中发生反应,10min内 N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L•min) | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时左码右物 | |
| C. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再滴加几滴水至刻度线 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只根据反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,不能判断出该反应△H的正负 | |
| B. | 对于反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),加入更多的催化剂会使平衡向正反应方向移动 | |
| C. | 向纯水中加入盐酸能使水的电离平衡逆向移动,但水的离子积不变 | |
| D. | 用惰性电极电解1 L 1 mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 mol Cu(OH)2固体可将溶液恢复至原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸(HCOOH)与正丁醇 | B. | 乙酸与甲醇(CH3OH) | ||
| C. | 乙醇与CH3CH2COOH | D. | CH3CH2COOH与甲醇(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com