
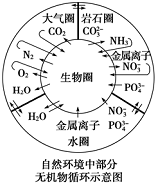
| A. | 金属离子和硝酸根离子进入生物圈可能形成环境污染 | |
| B. | 碳元素在自然界中的循环主要是通过CO2的生成和消耗来实现的 | |
| C. | 自然界中不存在硫及其化合物的循环,因为在示意图中没能体现 | |
| D. | 雷雨天氮气和氧气的反应属于自然固氮的一种方式 |
分析 A.重金属离子有毒;
B.动植物的呼吸产生二氧化碳,二氧化碳通过光合作用生成有机物和氧气;
C.含硫化合物燃烧生成二氧化硫;
D.雷雨天氮气和氧气的反应,游离的氮变硝酸中化合态的氮.
解答 解:A.重金属离子有毒,硝酸根能形成水体富营养化,形成环境污染,故A正确;
B.动植物的呼吸产生二氧化碳,二氧化碳通过光合作用生成有机物和氧气,碳元素在自然界中的循环主要是通过CO2的生成和消耗来实现的,故B正确;
C.含硫化合物燃烧生成二氧化硫,二氧化硫与氧气、水反应形成硫酸,故C错误;
D.雷雨天氮气和氧气的反应,游离的氮变硝酸中化合态的氮,属于自然固氮的一种方式,故D正确.
故选C.
点评 本题考查了元素及其化合物的性质和应用,涉及物质的种类较多,题目难度不大,掌握物质的化学性质是重点,但不要忽略物理性质的学习.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、H2O2 | B. | SO32-、MnO4-、H+、K+ | ||
| C. | Pb2+、K+、SO42-、Cl- | D. | Na+、SO32-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
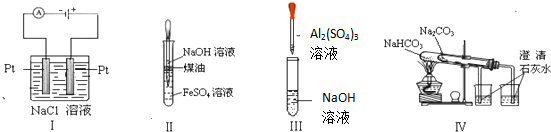
| A. | 实验Ⅰ:制取金属钠 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:制取少量的氢氧化铝 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3跟盐酸反应:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒、酒精灯 | 1.0mol/L FeCl3溶液、蒸馏水 |
| C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.100 0mol/L盐酸、酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCHCl3中含有的氯原子数目为3NA | |
| B. | 46g二氧化氮含有的原子总数一定为3NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2NHO3+4N2↑+9H2O该反应生成28gN2时,转移的电子数目为4NA | |
| D. | 在密闭容器中加入1,5molH2和0.5molN2,充分反应后可得到NH3分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com