
利用光能和光催化剂,可将 CO2和 H2O(g)转化为 CH4和 O2。紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示。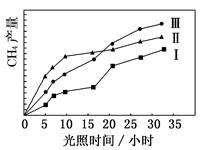
(1)在0~30 小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为________;反应开始后的 12 小时内,在第________种催化剂作用下,收集的 CH4最多。
(2)将所得 CH4与 H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
①画出反应过程中体系能量变化图(进行必要标注)。
②将等物质的量的CH4和 H2O(g)充入 1 L 恒容密闭反应器中,某温度下反应达到平衡,平衡常数 K = 27,此时测得 CO 的物质的量为 0.10 mol,求CH4的平衡转化率(计算结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802 kJ·mol-1。
写出由 CO2生成 CO 的热化学方程式____________________________________
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:填空题
(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:
(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知: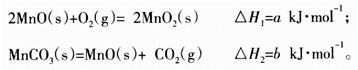
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示: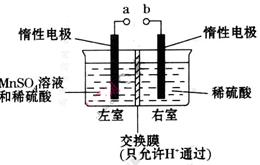
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为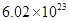 个,左室溶液中
个,左室溶液中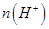 的变化量为________________。
的变化量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2-甲基丁烷 | 3 531.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l) ΔH2
CH3OH(g) + H2O(l) ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g) ΔH3=-41.1 KJ/mol ③
H2O (l) =H2O (g) ΔH4=+44.0KJ/mol ④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol?L-1)变化如下表所示:(前6min没有改变条件)
| | 2min | 4min | 6min | 8min | … |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l)ΔH=-285.8 kJ/mol
O2(g)=H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ,C的燃烧热为 。
(3)燃烧10 g H2生成液态水,放出的热量为 。
(4)CO的燃烧热为 ,其热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g) N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知H+(aq)+OH-(aq) H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热为 。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
能源危机促使世界各国寻找新的替代能源和开展对已有能源“高效利用”的技术研发。设计燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。以丁烷(已知丁烷的燃烧热为2 877.6 kJ·mol-1)为代表回答下列问题:
(1)写出丁烷燃烧的热化学方程式:________________;
(2)正丁烷的燃烧热:2 878 kJ·mol-1,异丁烷的燃烧热:2 869 kJ·mol-,正丁烷转化为异丁烷的过程中________(填“放出”或“吸收”)能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com