
|
X、Y是周期表中前20号中的两种元素(非稀有气体元素),X原子的半径比Y的半径小,且具有相同的电子层数(m、n均为正整数),下列有关叙述正确的是 | |
| [ ] | |
A. |
若Y最高价为+5,则X最高价一定为+6或+7 |
B. |
若HnXOm为强酸,则X的氢化物溶液于水一定显酸性 |
C. |
若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 |
D. |
X的离子半径一定比Y离子半径小 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
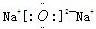
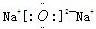
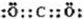
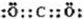
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?辽宁一模)[化学--选修3物质结构与性质]
(2013?辽宁一模)[化学--选修3物质结构与性质]| 417×1030 |
| a3NA |
| 417×1030 |
| a3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
2+ 0.45 |
3+ 0.5 |
2+ 0.25 |
3+ 0.70 |
2+ 0.15 |
3+ 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2754 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com