
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2016届甘肃省天水市高三上学期第三次测试化学试卷(解析版) 题型:选择题
下列各反应的化学方程式或离子方程式中,不正确的是
A.将点燃的镁条伸入充满CO2气体的集气瓶中:2Mg + CO2  2MgO+C
2MgO+C
B.大理石溶于醋酸:CO3 2- + 2CH3COOH = 2CH3COO- + CO2↑+ H2O
C.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
D.向淀粉KI溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:
4H+ +4I- + O2 = 2I2 +2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高一10月月考化学试卷(解析版) 题型:选择题
为了除去KCl中的Ca2+、Mg2+、SO42﹣及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液
⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量K2CO3溶液.
A.②⑤④①③ B.④①②⑤③
C.④②⑤ D.⑥⑤⑦①③
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期第一次月考化学试卷(解析版) 题型:选择题
a、b、c、d是HCl、AlCl3、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表.由此推出a、b、c、d依次为
反应物 | a+b | c+d | a+d | a+c | b+d |
现象 | ↓ | ↓↑ | ↓ | ↓ | ↑ |
A. AlCl3、HCl、AgNO3、Na2CO3 B. AgNO3、HCl、Na2CO3、AlCl3
C. Na2CO3、AlCl3、HCl、AgNO3 D. AgNO3、HCl、AlCl3、Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列有关化学概念或原理的论述中,正确的是
A.SO2、NH3的水溶液都能够导电,因此都属于电解质
B.电解饱和食盐水的过程中,水的电离平衡逆向移动
C.任何一个化学反应都可以设计为电池,输出电能
D.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市高三上学期10月月考化学试卷(解析版) 题型:选择题
室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
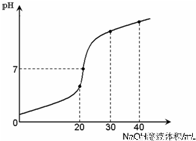
A.pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)= c(NH3·H2O) + c(OH-)
D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:实验题
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2。以孔雀石为原料可制备CuSO4·5H2O步骤如下:
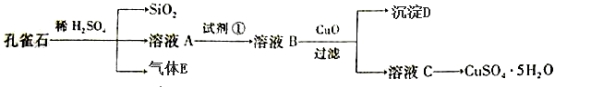
(1)写出孔雀石与稀硫酸反应的化学方程式:_________________________,为了提高原料浸出速率,可采取的措施有___________________(写出两条)。
(2)溶液A的金属离子有Cu2+、Fe2+。实验步骤中试剂①最佳选 (填代号)。
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(3)溶液B中加入CuO作用是__________________ ______。
(4)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3mol/L,必需将溶液pH调节至 。
(5)由溶液C获得CuSO4·5H2O晶体,需要经_____________、___________和过滤。
(6)可用KMnO4标准溶液测定溶液A 中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO4 10.00ml, A溶液中Fe2+的物质的量浓度_________mol/L(反应原理:MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O)。
中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO4 10.00ml, A溶液中Fe2+的物质的量浓度_________mol/L(反应原理:MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O)。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期期中测试理综化学试卷(解析版) 题型:填空题
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置 ______
(2)k3[Fe(CN)6]溶液可用于检验 ______(填离子符号)CN-中碳原子杂化轨道类型为 ____,C、N、O三元素的第一电离能由大到小的顺序为 ___(用元素符号表示)。
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=____________。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)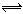 Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 _________。
(4)铜晶体铜碳原子的堆积方式如右图所示。

①基态铜原子的核外电子排布式为 ________________。
②每个铜原子周围距离最近的铜原子数目 。
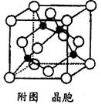
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 _______(填“离子”、“共价”)化合物。
③已知该晶体的密度为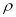 g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 ________________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省清远市高二上学期10月月考化学试卷(解析版) 题型:实验题
用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
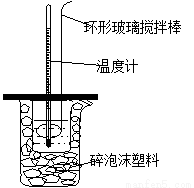
(1)烧杯中填满碎泡沫塑料的作用是 。
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替? (填“能”或“不能”),其原因是 。
(3)实验中若改用60mL0.50mol/L的盐酸与50 mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),若实验操作均正确,则所求中和热 (填“相等”或“不相等”)。
(4)已知在稀溶液中,强酸与强碱发生中和反应生成1molH2O,放出57.3kJ的热量,则上述反应的热化学方程式为
(5)实验中若改用60mL0.50mol/L的醋酸与50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“偏低”或“偏高”);原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com