
【题目】
(1)在空气质量报告的各项指标中,有SO2和NO2的指数.SO2是一种无色有毒气体,NO2是一种 (填“无色”或“红棕色”)有毒气体;
(2)氨气极易溶于水,其水溶液显 (填“酸”、“碱”或“中”)性;
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O在该反应中,浓H2SO4表现出 性(填“吸水”、“脱水”或“氧化”).
CO2↑+2SO2↑+2H2O在该反应中,浓H2SO4表现出 性(填“吸水”、“脱水”或“氧化”).
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述正确的是( )
A. 苯、油脂均不能使酸性KMnO4溶液褪色
B. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C. 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D. 除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5mol·L-1盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是
A. 0.05mol/L B. 0.25mol/L C. 0.1mol/L D. 0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.航天飞机上的隔热陶瓷瓦属于优质合金材料
B.将少量CO2通入CaCl2溶液能生成白色沉淀
C.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
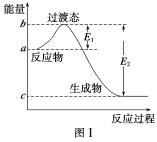
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。
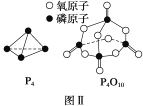
(2)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=___ _____ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
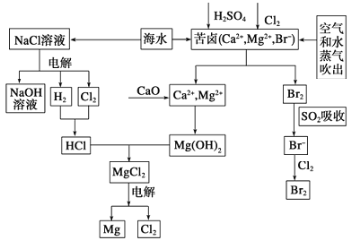
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ______________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是___________(写2条),电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选修3——物质结构与性质
已知A、B、C、D、E、F为元素周期表前四周期原子序数依次增大的六种元素。其中A的核外电子总数与其周期数相等,B原子核外有三个能级,每个能级上的电子数相同。D、E为同主族元素,且E的原子序数是D的2倍。F元素在地壳中含量位于金属元素的第二位。回答下列问题:
(1)元素F基态原子价层电子排布式为____________。
(2)B、C、D第一电离能由小到大的顺序为______________。(用元素符号表示)
(3)A与其它元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有 (写出其中两种的化学式)。
(4)BE2分子中,按原子轨道的重叠方式的不同存在的共价键类型有 ;B原子的杂化轨道类型为 ;写出两种与BE2互为等电子体的分子或离子 。
(5)F单质的晶体在不同温度下有两种堆积方式,即面心立方堆积和体心立方堆积,其晶胞的棱边长分别为a cm、b cm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______________,F原子配位数之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B. 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈
C. 生铁中含有碳,抗腐蚀能力比纯铁强
D. Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com