
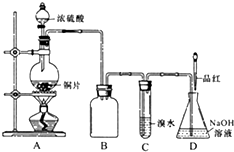
 某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.
某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | Ⅲ | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | Ⅱ | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
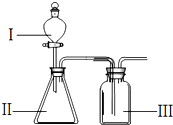
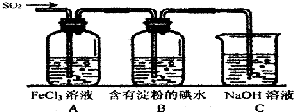 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
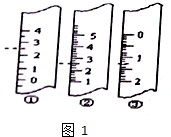 中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.
中用水稀释后转移到100mL容量瓶中定容,然后将稀释后的溶液倒入试剂瓶中.
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol.L-1 KMnO4溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D四种短周期元素,且A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图为:
A、B、C、D四种短周期元素,且A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图为: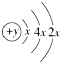
查看答案和解析>>
科目:高中化学 来源: 题型:
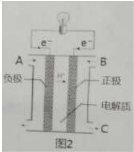
查看答案和解析>>
科目:高中化学 来源: 题型:
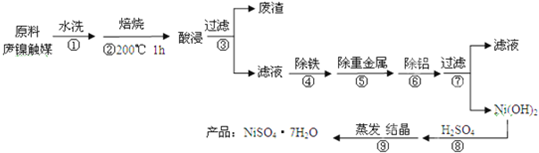
| 原料用量② m/g | 水用量 V(H2O)/ml | 硫酸用量 V(H2SO4)/ml | 浸出量 m(Ni)/g | 浸出率 E(Ni)/% |
| 100 | 200 | 10 | 11.40 | 87.69 |
| 100 | 200 | 20 | 11.60 | 89.23 |
| 100 | 200 | 50 | 11.65 | 89.62 |
| 100 | 200 | 100 | 11.66 | 89.69 |
| 100 | 200 | 150 | 11.68 | 89.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-4 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应HZ+Y-═HY+Z-不能发生 |
| C、此温度下,1 mol/L HZ溶液的pH=2 |
| D、此温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com