
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g) (正反应为吸热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g) (正反应为放热反应) | |
| D. | 2HI(g)?I2(g)+H2(g) (正反应为吸热反应) |
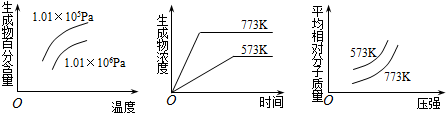
分析 由图可知,温度越高,生成物的浓度、百分含量越大,则升高温度平衡正向移动,正反应为吸热反应;温度相同时压强越大,平均相对分子质量越大,生成物的百分含量越小,则加压平衡逆向移动,即正反应为气体体积增大的反应,以此来解答.
解答 解:A.正反应为放热反应,且为气体体积减小的反应,故A不选;
B.正反应为吸热反应,且正反应为气体体积增大的反应,与图象符合,故B选;
C.正反应为放热反应,故C不选;
D.该反应为气体体积不变的反应,压强增大,平衡不移动,故D不选;
故选B.
点评 本题考查化学平衡移动,为高频考点,把握温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意图象分析及反应的特点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=+484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
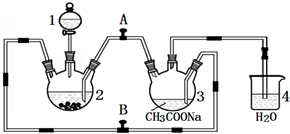 二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,正丁烷的燃烧热为-2878.0 kJ/mol | |
| B. | 相同质量的丙烷和丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 | |
| C. | 常温下,CO的燃烧热为566.0 kJ/mol | |
| D. | 人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同 | |
| B. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同 | |
| C. | 达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA | |
| D. | 达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | V(NaOH) | V (HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.02 | 0.00 | 16.69 | 16.69 | 0.1042 |
| 2 | 16.71 | 0.00 | 17.90 | 17.90 | |
| 3 | 19.52 | 0.00 | 20.79 | 20.79 | 0.1065 |
| 4 | 14.99 | 0.00 | 16.02 | 16.02 | 0.1069 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com