
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
 ,
, ;
;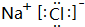 ,属于离子化合物,
,属于离子化合物,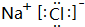 ;离子晶体;
;离子晶体;| 22.4L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液:Fe2+、K+、SO42-、NO3- |
| B、加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- |
| C、0.1 mol?L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| D、水电离出的c(H+)=10-12 mol?L-1的溶液:Na+、K+、NH4+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4g铜与硫反应失去的电子数为0.2NA |
| B、lmolNa2O2与水反应转移电子数为NA |
| C、2.9克乙基(-C2H5)含有的电子数为1.8NA个 |
| D、标准状况下:NA个NO、CO2、SO2分子所占的体积均约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 生石灰 | 醋酸 | 石灰水 | 水 |
| D | 苛性钠 | 碳酸 | 小苏打 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com