
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 常温下单质能与水剧烈反应生成氢气. | 第三周期元素的简单离子中半径最小 |
 ,X是氮元素,它的气态氢化物的电子式为
,X是氮元素,它的气态氢化物的电子式为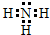 ,
, ;
;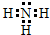 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、每生成1mol Fe3O4,反应转移的电子总数为3mol | ||
| B、Fe2+和S2O32-都是还原剂 | ||
C、1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
| ||
| D、x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 现有部分前四周期元素的性质、原子结构如下表:
现有部分前四周期元素的性质、原子结构如下表:| 元素 编号 | 元素性质、原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 第三周期主族元素中其电负性最大 |
| D | 元素的2p轨道无空轨道,且有两个单电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-(CH2)4-CH3 |
| B、CH3-(CH2)3-CH3 |
| C、CH3-CH2-CH(CH3)2 |
| D、(CH3)2C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如图所示实验装置.
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如图所示实验装置.| 浓度限值/(mg?m-3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
| 分组 | 第一小组 | 第二小组 |
| 抽气次数 | 100 | 120 |
| SO2含量/(mg?m-3) | 0.064 | 0.53 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com