
【题目】利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,蒸馏塔中发生反应的离子方程式是_____。
(2)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是_________、冷却结晶、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是___。
(3)海水提取镁要用到海滩上的贝壳,贝壳的作用是:_______,贝壳经历变化的化学方程式为:____,CaO+H2O = Ca(OH)2
(4)六水合氯化镁脱水变成无水氯化镁的工艺条件是:____
【答案】对溴元素进行富集 Cl2+2Br-=2Cl-+Br2 加热浓缩 MgCl2(熔融)![]() Mg+Cl2↑ 贝壳主要成分是CaCO3,能转化为Ca(OH)2 CaCO3
Mg+Cl2↑ 贝壳主要成分是CaCO3,能转化为Ca(OH)2 CaCO3 ![]() CaO + CO2↑ 在氯化氢气流加热蒸发脱水
CaO + CO2↑ 在氯化氢气流加热蒸发脱水
【解析】
(1)海水中含有溴元素的浓度低,提取溴时,需要富集,即经过2次Br-→Br2转化的目的是富集溴元素;根据流程,蒸馏塔中通入氯气,从吸收塔出来的溶液中含有Br-,即蒸馏塔中发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2;
(2)MgCl2→MgCl2·6H2O操作是加热浓缩、冷却结晶、过滤等步骤;工业上电解熔融状态的氯化镁冶炼金属镁,化学反应方程式为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
(3)贝壳中含有碳酸钙,煅烧贝壳可以得到CaO,CaO与水反应生成Ca(OH)2,与Mg2+反应生成Mg(OH)2;煅烧碳酸钙的反应方程式为CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(4)六水合氯化镁脱水变成无水氯化镁,为抑制Mg2+水解,因此六水合氯化镁脱水变成无水氯化镁的工艺条件在氯化氢气流中加热蒸发脱水。


科目:高中化学 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被![]() 腐蚀,其电化学腐蚀原理如图所示,下列说法正确的是
腐蚀,其电化学腐蚀原理如图所示,下列说法正确的是
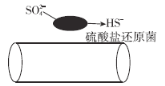
A.温度升高会使铁管道腐蚀程度加重
B.正极电极反应为![]()
![]()
C.酸性条件下,还原菌失去活性,铁管道不易被腐蚀
D.镀锌可保护铁管道不易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液的配制过程能引起浓度偏高的是( )
A.用1g98%的浓硫酸加4g水配成19.6%的硫酸
B.配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度
C.在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液
D.质量分数为5a%和a%的两种氨水等体积混合配成3a%的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L恒容密闭容器中充入2mol SiHCl3,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时发生反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH,SiHCl3的转化率随时间变化的结果如图所示。
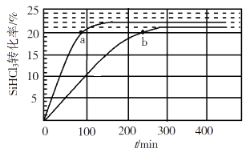
(1)上述反应每生成1g SiH2Cl2(g)吸收1.1kJ热量,则ΔH=______________。
(2)323K时,反应的平衡转化率α=______________。
(3)343K时,前200min内,SiCl4(g)的平均反应速率为______________。
(4)比较a、b两处反应速率大小![]() _______(填“>”“<”或“=”)
_______(填“>”“<”或“=”)![]() 。
。
(5)在343K条件下,要缩短反应达到平衡的时间,并且要增大平衡时SiH2Cl2(g)的浓度,可采取的措施是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法错误的是( )
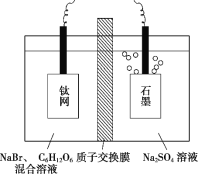
A.钛网与直流电源的正极相连,发生还原反应
B.石墨电极的反应为2H2O+2e-=H2↑+2OH-
C.电解过程中硫酸钠溶液浓度保持不变
D.生成葡萄糖酸的化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图转化关系,A与F分子中含碳原子数相同,均能与NaHCO3溶液反应,且A中含一个卤素原子,F的分子式为C9H10O2;D能发生银镜反应;M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种。
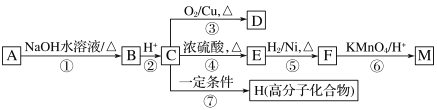
已知:![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
请回答:
(1)B、F的结构简式分别为__________、_________
(2)反应①~⑦中,属于消去反应的是_____________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________;反应⑦的化学方程式为__________
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中含有哪种卤素原子,确定该官能团的实验步骤和现象为_____________
(5)符合下列条件F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式__。
(2)元素④的离子结构示意图为___________。
(4)写出③的单质置换出⑥的单质的化学方程式:_____。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为________。
②的最高价氧化物对应水化物与⑤的最高价氧化物反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H为中学化学中常见的物质,转化关系如下所示,其中“O”代表化合物,“□”代表单质,A为医疗上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体.
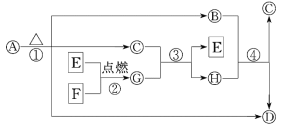
请回答下列问题:
(1)G的化学式为________,每生成1 mol G转移电子________mol.
(2)反应①②③④中________(填序号)属于氧化还原反应.
(3)写出下列反应的化学方程式:A→B+C+D:_______________________________,F+C:________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6. 02×1023个分子所占的体积约是22. 4 L
②0. 5 mol H2所占体积为11. 2 L
③标准状况下,1 mol H2 O的体积为22.4 L
④标准状况下,28 g CO与N2的混 合气体的体积约为22. 4 L
⑤各种气体的气体摩尔体积都 约为22. 4 L/mol
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤B.④⑥C.③④⑥D.①④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com