
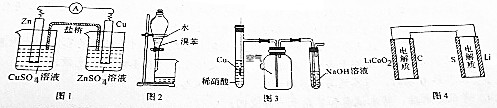
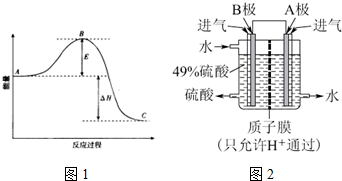
| A. | 图1装置设计铜锌双液原电池 | |
| B. | 图2装置用于分离水和溴苯的混合物 | |
| C. | 图3装置用于制备并收集NO气体 | |
| D. | 图4装置锂硫电池(2Li+S$?_{充电}^{放电}$Li2S)给锂离子电池充电(LixC+Li1-xCo2$?_{充电}^{放电}$C+LiCoO2) |
分析 A.含有盐桥的原电池中,电极材料与其相对应的电解质具有相同的金属元素;
B.互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离;
C.NO不属于水,但易被氧气氧化生成二氧化氮;
D.给电池充电时,负极与外接电源的负极相连,正极与外接电源的正极相连.
解答 解:A.含有盐桥的原电池中,电极材料与其相对应的电解质具有相同的金属元素,所以要使该装置构成原电池,则两个电极应该互换,否则不能构成原电池,故A错误;
B.互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离,溴苯和水不互溶,则可以采用分液方法分离,故B正确;
C.NO不属于水,但易被氧气氧化生成二氧化氮,则应该采用排水法收集NO,故C错误;
D.图中表示锂硫电池给锂离子电池充电,右边电极材料是Li和S,锂负极,硫为正极,左边电极材料是C和LiCoO2,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe--xLi+=Li1-xCoO2;C为阴极得电子发生还原反应:
C+xe-+xLi+=LixC,则C与负极Li相连,LiCoO2应与正极S相连,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及原电池原理、气体的收集、物质分离和提纯等知识点,明确实验原理、物质性质、实验基本操作是解本题关键,D选项是解答本题难点,题目难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属性比硫强 | B. | 气态氢化物的化学式为H2Se | ||
| C. | 酸性:H2SeO4>H2SO4 | D. | 最高价氧化物的化学式是SeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

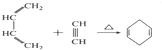
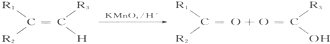
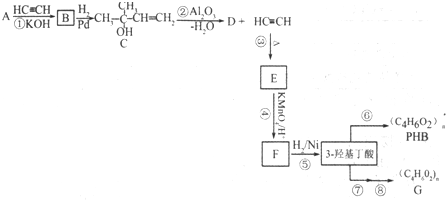
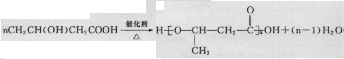
 B.
B.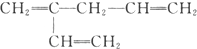 C.
C.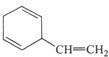 D.
D.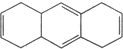
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
| 无水乙醇 | -114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
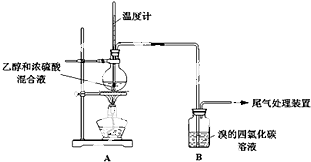
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
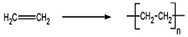 ,加聚反应.
,加聚反应.| 设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com