
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
(1)元素C在周期表中的位置是________________;
(2)化合物M中含有的化学键类型有__________;
(3)写出化合物Y与Z之间反应的离子方程式:_______________________________;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则正极上的电极反应式为________________;若以该电池作为电源,用惰性电极电解
查看答案和解析>>
科目:高中化学 来源: 题型:
碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。
该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为________L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
①实验A中以v(H2)表示的反应速率为___________________。
②通过计算可知,CO的转化率实验A_______________实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源:2010届郑州高中毕业班第三次质量预测理综化学部分 题型:填空题
碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。
该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为________L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: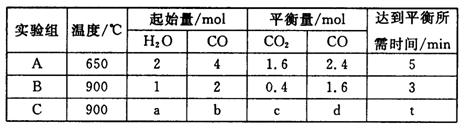
①实验A中以v(H2)表示的反应速率为___________________。
②通过计算可知,CO的转化率实验A_______________实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源:2010届郑州高中毕业班第三次质量预测理综化学部分 题型:
碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。
该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为________L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
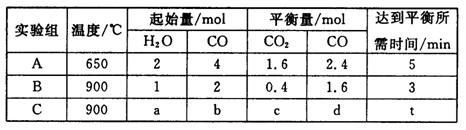
①实验A中以v(H2)表示的反应速率为___________________。
②通过计算可知,CO的转化率实验A_______________实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳及其含碳化合物在人们的生产生活中应用广泛。
(1)天然气是人们日常生活中的清洁能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
则反应2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料电池的化学方程式为CH4+2O2=CO2+2H2O。某甲烷燃料电池以甲烷为燃料,以空气为氧化剂,以熔融的K2CO3(其中不含O2-和HCO3—)为电解质,以具有催化作用和导电性能的稀土金属为电极。
该燃料电池的负极电极反应式为:CH4-8e-+4CO32—=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________物质。
(3)以该燃料电池为电源,以铂作电极电解1000g 4.55%的NaOH溶液,一段时间后,溶液中溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为________L。
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
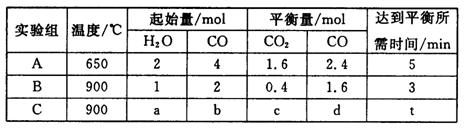
①实验A中以v(H2)表示的反应速率为___________________。
②通过计算可知,CO的转化率实验A_______________实验B(填“大于”、“等于”或“小于”),该反应的正反应为______________热反应(填“吸”或“放”)。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是_________________(用含a、b的数学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com