
已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+O2(g)=2H2O(g) △H2
C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
科目:高中化学 来源: 题型:单选题
石墨烯是由碳原子构成具有片状结构的新型纳米材料(结构示意图如下),可通过剥离石墨而成,具有极好的应用前景。下列说法正确的是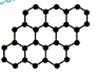
| A.石墨烯是一种有机化合物 |
| B.0.0012kg石墨烯中含有0.6mol质子 |
| C.不用其它试剂,利用丁达尔现象即可区分石墨和石墨烯 |
| D.剥离石墨属于物理变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[物质结构与性质](15分)
已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型常见气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。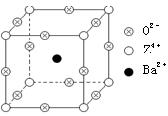
(1)Y在周期表中位于______________;Z4+的核外电子排布式为______________;
(2)X的该种氢化物分子构型为___________,X在该氢化物中以___________方式杂化。X和Y形成的化合物的熔点应该_____(填“高于”或 “低于”)X的该氢化物的熔点。
(3)①制备M的化学反应方程式是________________________________________;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的______;
③在M晶体中,Z4+的氧配位数为________;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为____ 。元素B、C、D的第一电离能由大到小的排列顺序为 。 (用元素符号表示)
(2)D元素原子的最外层电子排布图为 。DC42-的立体构型为____ 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。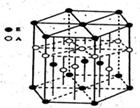
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ下列描述中正确的是( )
| A.CS2为V形的极性分子 |
B.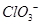 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有6对完全相同的成键电子对 |
D.SiF4和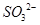 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
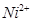 和
和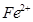 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
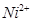 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与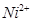 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知A、B、C、D均是气体,反应A+B  C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是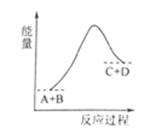
A.当A的正反应速率与C的逆反应速率相同时处于平衡状态
B.当A、B、C、D的浓度相同时,反应处于平衡状态
C.反应物的总键能量低于生成物的总键能
D.该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为: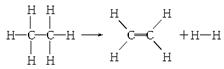
若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是( )
| A.该反应放出251.2 kJ的热量 | B.该反应吸收251.2 kJ的热量 |
| C.该反应放出125.6 kJ的热量 | D.该反应吸收125.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+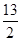 O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+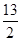 O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+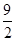 O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+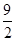 O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
| A.ΔH=-2 878 kJ·mol-1 | B.ΔH=-2 658 kJ·mol-1 |
| C.ΔH=-1 746 kJ·mol-1 | D.ΔH=-1 526 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com