
数据编号 | NaOH加入的体积/mL | 溶液的PH | ||
| c(HX) | c(HY) | |||
| ① | 0 | 3 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力顺序HX<HY | |
| B. | 由表中数据可估算出Ka(HY)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(HX)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
分析 A.根据表中数据分析,0.1000mol•L-1的酸HX、HY的pH分别为3、1,可知HX为弱酸、HY为强酸,同浓度的两种酸溶液的导电能力顺序HX<HY;
B.HY为强酸,不存在电离平衡常数;
C.根据混合液中的物料守恒和电荷守恒分析;
D.HY为强酸,与氢氧化钠反应时HY酸过量,溶液显酸性,c(H+)>c(OH-).
解答 解:A.由①知,0.100 mol/L的HY溶液的pH=1,说明HY是强酸;而0.100 mol/L的HX溶液的pH=3,说明HX是弱酸.所以在相同温度下,同浓度的两种酸溶液的导电能力顺序HX<HY,故A正确;
B.根据分析可知,HY为强酸,则不存在电离平衡常数,故B错误;
C.将0.100 mol/L的HX和HY混合,当达平衡时,根据物料守恒得①c(X-)+c(HX)=c(Y-),将①代入到电荷守恒c(H+)=c(X-)+c(Y-)+c(OH-)中可得:c(H+)=2c(X-)+c(HX)+c(OH-),故C错误;
D.上述②反应后的HX溶液显中性,因为HX为弱酸,则a<20.00 mL,由于HY为强酸,故HY酸过量,c(H+)>c(OH-),结合电荷守恒可知:c(Y-)>c(Na+),溶液中正确的离子浓度大小为:c(Y-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选A.
点评 本题考查了酸碱混合的定性判断及离子浓度大小比较,题目难度中等,根据表中数据判断HX、HY的酸性强弱为解答关键,注意掌握电荷守恒、物料守恒的含义及在判断离子浓度大小中的应用,明确酸碱混合的定性判断方法及溶液pH的计算方法.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(H2A) | c(NaOH) | ||
| ① | X | 0.10 | 9 |
| ② | 0.10 | 0.10 | 5 |
| A. | X<0.1 | |
| B. | HA-的电离程度大于水解程度 | |
| C. | 将实验①所得溶液加水稀释后,$\frac{c({A}^{2-})}{c(H{A}^{-})}$变大 | |
| D. | 实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 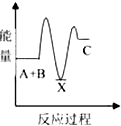 | B. | 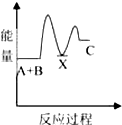 | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
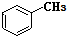 和
和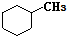 .其中互为同分异构体的是①③④(填序号).
.其中互为同分异构体的是①③④(填序号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com